
 甲烷可用氧化铁作催化剂实现选择性地催化脱硝.
甲烷可用氧化铁作催化剂实现选择性地催化脱硝.分析 (1)依据氧化铁催化机理图可知脱硝机理中第Ⅱ步四氧化三铁与一氧化氮反应生成氧化三铁和氮气;
(2)①N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1;
②×2-①得:2CH4(g)+2NO(g)+3O2(g)═2CO2(g)+4H2O(l)+N2(g),依据盖斯定律计算反应热;
解答 解:(1)依据氧化铁催化机理图可知脱硝机理中第Ⅱ步四氧化三铁与一氧化氮反应生成氧化三铁和氮气,方程式:4Fe3O4+2NO=6Fe2O3+N2,
故答案为:4Fe3O4+2NO=6Fe2O3+N2;
(2)①N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1;
②×2-①得:2CH4(g)+2NO(g)+3O2(g)═2CO2(g)+4H2O(l)+N2(g),△H,依据盖斯定律△H=2△H2-△H1=-890kJ•mol-1×2-180kJ•mol-1
=-1960kJ•mol-1;
所以反应的热化学方程式:2CH4(g)+2NO(g)+3O2(g)═2CO2(g)+4H2O(l)+N2(g),△H=-1960kJ•mol-1;
故答案为:2CH4(g)+2NO(g)+3O2(g)═2CO2(g)+4H2O(l)+N2(g),△H=-1960kJ•mol-1;
点评 本题考查了氧化还原方程式、热化学方程式书写,明确反应机理,熟悉盖斯定律计算反应热的方法即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .有机物X的键线式为
.有机物X的键线式为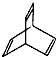
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Penguinone分子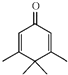 所有碳原子不可能都在同一个平面上 所有碳原子不可能都在同一个平面上 | |
| B. | 1mol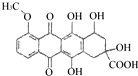 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol | |
| C. | 醋酸和软脂酸互为同系物,C5H12和C9H20也一定互为同系物 | |
| D. | 蛋白质遇到醋酸铅生成沉淀,加入大量的水,沉淀还可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L盐酸 | B. | 0.01mol/L盐酸 | C. | 0.1mol/L醋酸 | D. | 0.01mol/L醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
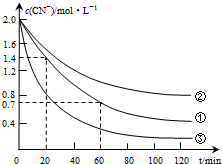
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+CO32- | |
| B. | NO2溶于水:3NO2+H2O=2H+$_{\;}^+$+2NO3-+NO | |
| C. | 醋酸溶液与水垢中的Mg(OH)2反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com