
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,混合液的pH>7 | |
| D. | a1mLb1mol•L-1盐酸和a2mLb2mol•L-1氨水混合至中性,b1=b2,则a1<a2 |
分析 A.硫化氢为二元弱酸;
B.一水合氨为弱电解质,加水稀释促进电离;
C.醋酸浓度较大;
D.如恰好反应,则溶液呈酸性,如呈中性,氨水应稍过量.
解答 解:A.硫化氢为二元弱酸,的H2S溶液中存在H2S、HS-以及水的电离,c(H+)>c(HS-),故A错误;
B.一水合氨为弱电解质,加水稀释促进电离,a<b+1,故B错误;
C.pH=2的CH3COOH溶液与pH=12的NaOH溶液相比较,醋酸浓度较大等体积混合酸过量,溶液pH<7,故C错误;
D.如恰好反应,则溶液呈酸性,如呈中性,氨水应稍过量,故D正确.
故选D.
点评 本题考查了溶液pH的计算、溶液中离子浓度大小比较等知识,题目难度中等,注意掌握酸碱混合后溶液的定性判断及溶液中pH的计算方法,明确弱酸的电离特点,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、淡水 | B. | 氯、溴、碘 | C. | 钠、镁、铝 | D. | 烧碱、氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘水,变蓝色;新制Cu(OH)2,砖红色沉淀;浓硝酸,变黄色 | |
| B. | 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀;碘水,变蓝色 | |
| C. | 新制Cu(OH)2,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色 | |
| D. | 碘水,变蓝色; 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 17.4g某硫化磷(如图) 中含P-S键数目为0.6NA 中含P-S键数目为0.6NA | |
| C. | 每个分子中含8个碳原子的某烃,1mol烃中含碳碳单键的个数最多为7NA | |
| D. | 标准状况下,22.4LSO2与O2的混合气体,含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于0.2mol•L-1 | B. | 等于0.2mol•L-1 | C. | 小于0.2mol•L-1 | D. | 无法估算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量 | |
| B. | 1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量 | |
| C. | 1 mol H2(g)与1 mol I2(g)完全反应生成 2 mol的HI气体需吸收52 kJ的热量 | |
| D. | 1 mol H2(g)与1 mol I2(g)完全反应放出26 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
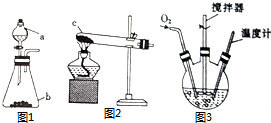 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com