
| A. | 在pH=12的溶液中,K+、Cl-、AlO2-、NH4+可以大量共存 | |
| B. | 由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O?HA+OH- | |
| C. | 由0.1 mol•L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH- | |
| D. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
分析 A.pH=12的溶液,显碱性;
B.0.1 mol•L-1一元酸HA溶液的pH=3,则酸为弱酸;
C.0.1 mol•L-1一元碱BOH溶液的pH=10,则碱为弱碱;
D.pH=0的溶液,溶液显酸性,离子之间发生氧化还原反应.
解答 解:A.pH=12的溶液,显碱性,则不能大量存在NH4+,故A不选;
B.0.1 mol•L-1一元酸HA溶液的pH=3,则酸为弱酸,则NaA溶液存在水解离子反应为A-+H2O?HA+OH-,故B选;
C.0.1 mol•L-1一元碱BOH溶液的pH=10,则碱为弱碱,则BOH溶液存在电离方程式为BOH?B++OH-,故C不选;
D.pH=0的溶液,溶液显酸性,NO3-、SO32-、H+发生氧化还原反应,不能大量共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、盐类水解的离子共存及反应考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 还原剂是HCl,氧化剂是MnO2 | |
| B. | 每消耗1mol MnO2,转移电子的物质的量为2 mol | |
| C. | 每转移1mol电子,则可以制得标况下Cl2 22.4L | |
| D. | 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | FeCl2 | C. | KOH | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 常温下c(H+)=1×10-13 mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、HCO3- | |
| D. | 透明溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
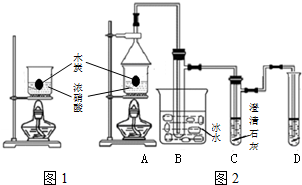 浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:
浓硝酸是一种常见的酸,加热或见光易分解生成NO2.某实验小组欲探究碳与浓硝酸的反应情况.实验装置如图.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com