
【题目】在含有H+、Cl-、Na+的溶液中,还可以大量共存的离子是
A. CO32- B. AlO2- C. Ca2+ D. Ag+
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如右图所示。下列说法正确的是
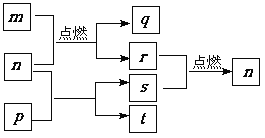
A. Y、Z、W的简单离子的电子层结构相同
B. 原子半径:r(X)<r(Y)<r(Z)<r(W)
C. 简单氢化物的稳定性:X>Y
D. Y与Z两种元素形成的化合物一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应的是( )
A.CO2+H2O═H2CO3
B.H2CO3═CO2↑+H2O
C.CaCO3+2HCl═CaCl2+H2O+CO2↑
D.H2+F2═2HF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、。C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系。

(1)写出实验室制取A的单质的离子反应方程式: 。
(2)戊的分子式为__________。B与D形成的原子个数比为2∶1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式__________。
(3)A的单质与丙常温下发生反应生成甲与D的单质,该反应的化学方程式_________。
(4)实验室配制庚溶液的是按方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/L的H2SO4溶液混合,3min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速度增大到原来的3倍,那么40℃时,同样的反应要同样看到浑浊,需要的时间是
A.40s B.15s C.30s D.20s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:

(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由_______________。
(2)25℃时,将pH = 11的NaOH溶液与pH = 4的H2SO4溶液混合,若所得混合溶液的pH = 10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(3)95℃时,若10体积pH1= a的某强酸溶液与1体积pH2= b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________。
(4)曲线B对应温度下,pH = 2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学知识在生产和生活中有着重要的应用。下列说法中正确的是
A.依据铝热反应原理,能发生反应2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
B.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
C.硫酸铁和明矾都可用于净水
D.Na2CO3可以与胃酸反应,可用Na2CO3治疗胃酸过多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com