
| A. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| B. | 能自发进行的反应一定能迅速发生 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都可能自发 |
分析 A.由反应可知,△H>0、△S>0,能自发进行,则△H-T△S<0;
B.能自发进行的反应,反应速率不一定快;
C.利用△H-T△S与0的关系判断;
D.△H-T△S<0可自发进行.
解答 解:A.由反应可知,△H>0、△S>0,能自发进行,则△H-T△S<0,则能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向,故A正确;
B.能自发进行的反应,反应速率不一定快,如食物腐败、铁生锈等,故B错误;
C.利用△H-T△S与0的关系判断,不能单独使用焓变、熵变判断反应进行的方向,故C错误;
D.△H-T△S<0可自发进行,可知△H>0、△S>0的反应,在低温下不能自发进行,高温下可自发进行,故D错误;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握焓变、熵变的判断及反应进行方向的综合判据为解答的关键,侧重分析与应用能力的考查,注意不能单独使用焓变、熵变判断反应进行的方向,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Cl- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | H+、K+、HCO3-、Cl- | D. | Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淀粉检验食盐中是否含碘元素 | |
| B. | 用醋、石灰水验证蛋壳中含有碳酸盐 | |
| C. | 用碘酒检验汽油中是否含有不饱和烃 | |
| D. | 用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的摩尔质量为71 | |
| B. | 已知Fe(OH)3胶粒带正电,向氢氧化铁胶体中滴加NaHSO4溶液至过量,最终能得到Fe(OH)3沉淀 | |
| C. | 2L 1mol/LAlCl3溶液中,Cl-物质的量浓度为3mol/L | |
| D. | 阿伏加德罗常数的数值就是0.012kg碳中含有的碳原子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18.0 g NH4+中所含的质子数为10 NA | |
| B. | 室温下,8 g甲烷含有共价键数为2NA | |
| C. | 常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | |
| D. | 常温下,1 mol/L 的 Na2SO4溶液中含有Na+个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管用水洗后,未用标准溶液润洗就装入标准溶液 | |
| B. | 用于取待测液的滴定管未用待测液润洗 | |
| C. | 在摇动锥形瓶的过程中不慎溅出了一小部分溶液 | |
| D. | 标准液读数时,滴定前仰视,滴定后俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
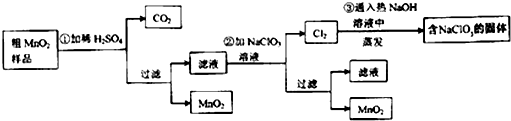
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com