
【题目】将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法中正确的是__(填序号).

A.甲、乙均为化学能转变为电能的装置
B.甲中铜为正极,乙中铜为负极
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中的pH值均增大
(2)在相同时间内,两烧杯中产生气泡的速率:甲__乙(填“>”、“<”或“=”).
(3)写出甲池中负极反应的电极反应式为:_______________________________。
(4)当甲中产生3.36L(标准状况)气体时,理论上通过导线的电子数目为____________。
【答案】D > Zn-2e-=Zn2+ 0.3NA(或1.806×1023)
【解析】
(1)甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌与溶液中的氢离子发生氧化还原反应,锌电极上冒气泡,据此分析作答;
(2)作原电池负极的金属,反应速率比普通化学反应快;
(3)负极锌失电子发生还原反应;
(4)根据氢气和转移电子之间的关系式计算;
(1)A. 甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,A项错误;
B. 乙不能构成原电池,氢离子在锌片上得电子发生还原反应,铜不能作正极,B项错误;
C. 甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,C项错误;
D. 两烧杯总反应均为锌和氢离子发生的置换反应,最终导致溶液中氢离子浓度减小,所以溶液的pH均增大,D项正确;
故答案为D;
(2)甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙;
(3)甲池中负极发生锌失电子的氧化反应,其电极反应式为:Zn-2e-=Zn2+;
(4)甲中,铜电极上氢离子得电子生成氢气,若产生的3.36 L氢气在标准状况下的物质的量=![]() =0.15mol,根据电极反应式为2H++2e-=H2↑可知,理论上通过导线的电子数目为0.15×2×NA=0.3NA(或1.806×1023)。
=0.15mol,根据电极反应式为2H++2e-=H2↑可知,理论上通过导线的电子数目为0.15×2×NA=0.3NA(或1.806×1023)。


科目:高中化学 来源: 题型:
【题目】工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C. SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D. SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法正确的是
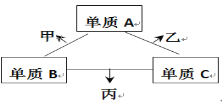
A. 甲、乙、丙三种物质的水溶液均显碱性
B. 甲是碱性氧化物,乙是酸性氧化物
C. 甲、乙可能都有漂白性,其漂白原理相同
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为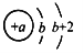 。
。
W | X | Y |
Z |
请回答下列问题:
(1)Z元素在元素周期表中的位置是__________________________________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序为_________(元素符号表示)。
(3)X、Z、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序为________(用化学式表示)。
(4)用电子式表示WY2的形成过程__________________________________。
(5)写出W单质与浓硫酸反应的化学方程式_____________________________。
Ⅱ. A、B、C三种物质存在如图转化关系。
![]()
(6)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中指出“持续实施大气污染防治行动,打赢蓝天保卫战”。SO2为大气污染物,研究它的性质对治理具有重要意义。在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
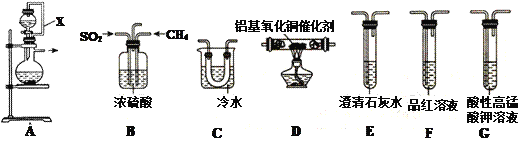
(1)①装置中导管X的作用是:______________________________。
②用装置A制取SO2,则试剂的组合最好是_________(填字母)。
a. 18.4 mol/L H2SO4+Cu b. 4 mol/L HNO3+Na2SO3 c. 60% H2SO4+K2SO3
③水与Al4C3在装置A中制取甲烷,其化学方程式为:________________。
(2)利用制得的CH4和SO2并结合B~G装置验证反应:CH4+2SO2 .![]() 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
①B装置有三个作用,分别是________________________、充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2。
②实验装置依次连接的合理顺序为B、_____________________(每个装置只用一次)。
③证明有CO2产生的现象为_____________________________。
④G装置中发生反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
ⅠA | 0 | ||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | B | ① | ② | Ne | |||||
3 | ③ | ④ | ⑤ | Si | ⑥ | ⑦ | |||
(1) ①的元素符号是__________
(2) ②和⑥两种元素的原子半径大小关系:_________(填“>”或“<”);
(3) ③和⑤两种元素的金属性强弱关系:________(填“>”或“<”);
(4)③和⑦形成的化合物属于_________(填“离子化合物”或“共价化合物”);写出该化合物的电子式为:______________________;
(5)写出元素②在周期表中的位置_______________________;
(6)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是常用的有机物的表示方法:
①![]() ②
② ③CH4 ④
③CH4 ④ 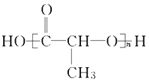 ⑤
⑤![]()
⑥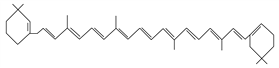
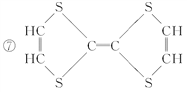
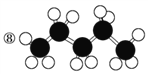
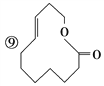
⑩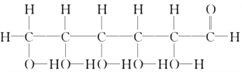
(1)上述表示方法中属于结构简式的为__________;
属于结构式的为________;
属于键线式的为________;
属于比例模型的为________;
属于球棍模型的为________。
(2)写出⑨的分子式:________。
(3)写出⑩中官能团的电子式:________、________。
(4)②的分子式为________,最简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美宇航局(NASA)提醒人类:环保、素食、节能将有效抑制温室效应;否则两极冰山将融化,它将引发一系列灾难。美国宇航局(NASA)马里诺娃博士发现了一种比二氧化碳高104倍的“超级温室气体”全氟丙烷(C3F8),提醒人们慎用含氟物。有关全氟丙烷的说法正确的是
A. 由丙烷转化为全氟丙烷的反应为取代反应
B. 全氟丙烷的电子式为:![]()
C. 分子中三个碳原子可能处于同一直线上
D. 全氟丙烷可由全氟丙烯(CF2CFCF3)与H2加成得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲线如下图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是
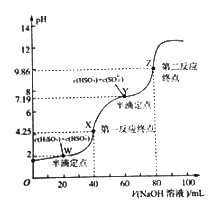
A. H2SO3的Ka1=1×10-2
B. 0.05mol/L NaHSO3溶液的PH=4.25
C. 图中Y点对应的溶液中,3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. 图中Z点对应的溶液中:c(Na+)> c(SO32-)> c(HSO32-)> c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com