
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度 g/100gH2O | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
| ||
| ||
| ||
| ||
| m |
| M |
| 4×10-3g |
| 40g/mol |
| n |
| V |
| 1×10-4mol |
| 10×10-3L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
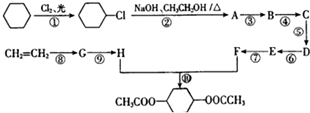
查看答案和解析>>
科目:高中化学 来源: 题型:
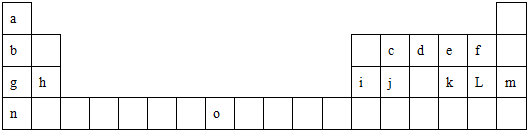
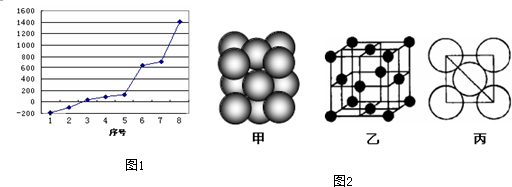
查看答案和解析>>
科目:高中化学 来源: 题型:
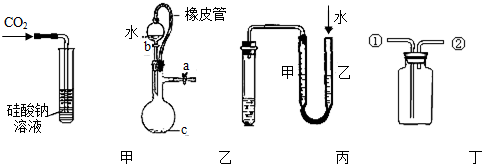
| A、甲装置:可用来证明碳的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法不能检查此装置的气密性 |
| D、丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与NaOH溶液反应:2Al+2 OH-+2H2O═2 AlO2-+3H2↑ |
| B、铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ |
| C、向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
| D、Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| CH |
| | |
| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
| B、Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C、向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com