
(1) 2molO3与3 molO2的质量之比___________,分子数之比__________,同温同压下的密度之比________,含氧原子数之比_______________,体积之比____________________。
(2) O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10LO3与____________L Cl2的消毒能力相当。
(3)气体化合物A分子式可表示为OxFy,己知同温同压下l 0 mL A受热分解生成15 mLO2和10 mL F2,则A的化学式为____________推断的依据为___________________。
【知识点】 阿伏加德罗定律的应用 A2
【答案解析】(1)1∶1 2∶3 3∶2 1∶1 2∶3
(2)30 (3)O3F2
解析: (1) 2molO3与3 molO2的质量之比:(2mol×48g/mol):(3mol×32g/mol)=1:1,根据阿伏伽德罗定律,分子数之比等于物质的量之比2:3;同温同压下的密度之比等于摩尔质量比为3:2;含氧原子数之比1:1,体积之比等于物质的量之比2:3。
(2) O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,二者消毒能力相当,就是二者转移等量电子,则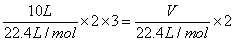 ,解得V=30L。
,解得V=30L。
(3)根据同温同压下气体的体积比等于物质的量之比,l 0 mL A受热分解生成15 mLO2和10 mL F2,方程式为:2A=3O2+2F2则A的化学式为O3F2 推断的依据为阿伏加德罗定律和质量守恒定律.
【思路点拨】本题考查了阿伏加德罗定律的应用,注意灵活应用同温同压下气体的密度之比等于摩尔质量比,同温同压下气体的体积之比等于物质的量之比分析问题。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
合成氨的流程示意图如下:
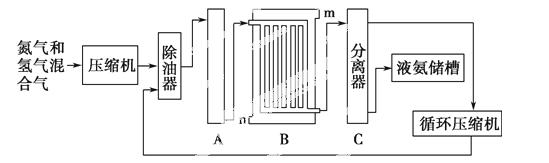
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是________、________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学方程式_______________________。
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为____________。
(3)设备B的名称为________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是______________。
(4)设备C的作用是______________________。
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
决定物质性质的重要因素是物质结构,请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中 重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3 401 |
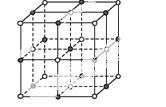
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填序号)。
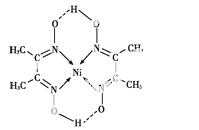
A.离子键 B.极性键
C.金属键 D.配位键
E.氢键 F.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3
D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶 液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是
液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是
A.原溶液中c(Br-)=0.4mol/L B.反应后溶液中c(Fe3+)=c(Fe2+)
C.反应后溶液中c(Fe3+)=0.1mol/L D.原溶液的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对有关知识的理解正确的是( )
A.物质的量是物质所含微粒的数量
B.1摩尔氧气的质量等于NA个O2分子的相对分子质量之和
C.阿伏加德罗常数是人们规定的数,没有单位
D.当H2的摩尔质量以g·mol-1为单位时,在数值上与H2的相对分 子质量相等
子质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A.体积 相等时密度相等 B.原子数相等时具有的中子数相等
相等时密度相等 B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A.1∶1 B.2∶1 C.3∶1 D.1 ∶3
∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银 ②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、氯化银 ④同素异形体:C60、C70、金刚石、石墨
A.只有①③ B.只有②③ C.只有③④ D.只有④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com