
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
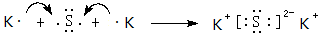 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. 分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体化学性质最不活泼;
(2)最高价氧化物的水化物中,酸性最强的化合物的分子式为HClO4;同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;
(3)氢氧化铝属于两性氢氧化物,⑨的最高价氧化物对应水化物为氢氧化钾,与氢氧化铝反应发生偏铝酸钾与水;
(4)⑨和⑥形成的离子化合物为K2S,由钾离子与硫离子构成,用K原子、S原子表示其形成过程.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,故答案为:Ar;
(2)最高价氧化物的水化物中,酸性最强的化合物的分子式为HClO4;上述元素中K的金属性最强,故碱性最强的为KOH,故答案为:HClO4;KOH;
(3)Al(OH)3属于两性氢氧化物,则最高价氧化物是两性氧化物的元素是Al,⑨的最高价氧化物对应水化物为氢氧化钾,与氢氧化铝反应发生偏铝酸钾与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al;Al(OH)3+OH-=AlO2-+H2O;
(4)⑨和⑥形成的离子化合物为K2S,由钾离子与硫离子构成,用K原子、S原子表示其形成过程为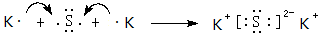 ,
,
故答案为: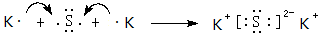 ;离子.
;离子.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,需要学生熟练掌握周期表的结构、熟记元素符号,注意理解电子式表示物质或化学键的形成.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
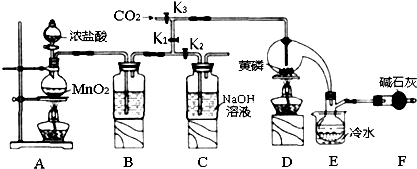
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 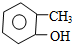 邻甲基苯酚 邻甲基苯酚 | |
| D. | 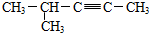 2-甲基-3-戊炔 2-甲基-3-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 含氧酸可作氧化剂而无氧酸则不能 | |
| C. | 金属原子失电子数越多,其还原性越强 | |
| D. | 金属单质在反应中只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先装好药品,再检查装置的气密性 | |
| B. | 先用双手握紧试管,再将导管插入水中检查装置气密性 | |
| C. | 结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管 | |
| D. | 稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2在反应①中作氧化剂,在反应②中作还原剂 | |
| B. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| C. | 在H2O2分解过程中,Fe2+起到催化剂的作用 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com