

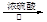 CO↑+H2O
CO↑+H2O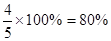 。(5)将样品溶于H2SO4,其中CuO被溶解,过滤出不溶物,洗涤、干燥、称得的质量即为Cu的质量。
。(5)将样品溶于H2SO4,其中CuO被溶解,过滤出不溶物,洗涤、干燥、称得的质量即为Cu的质量。

科目:高中化学 来源:不详 题型:单选题
| A.除去NO中混有的NO2:水、洗气 |
| B.除去乙酸乙酯中混有的少量乙酸:氢氧化钠溶液、分液 |
| C.除去乙醇中的少量水:金属钠、蒸馏 |
| D.除去二氧化硫中混有的少量二氧化碳:澄清石灰水、洗气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
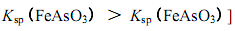
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+ | B.SO42- | C.Ba2+ | D.NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验目的 | 操作或现象 |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热, 充分反应并冷却后,向溶液中加稀 HNO3酸化,再滴加AgNO3溶液 |
| D | 证明溶液中存在平衡:Fe3+ +3SCN-??Fe(SCN)3 | 将1 mL KSCN溶液与1 mL同浓度 FeCl3溶液充分混合;再继续加入KSCN 溶液,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
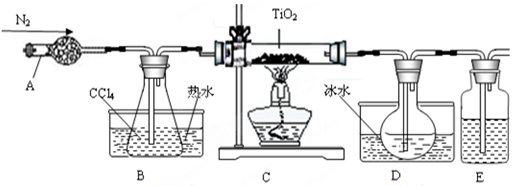
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
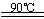 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)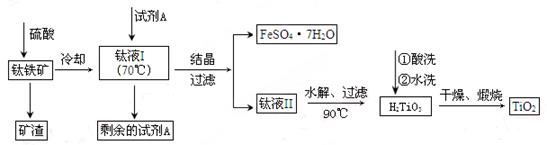
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
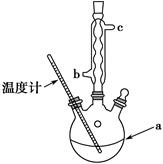
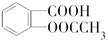 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: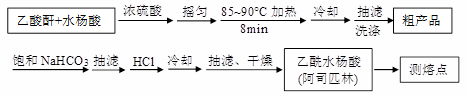
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
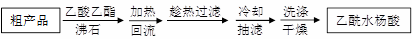
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com