
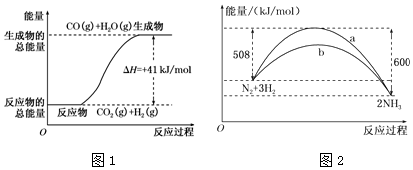
分析 (1)图象分析生成物能量高于反应物可知为吸热反应,则根据图象该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,又气态水变成液态水还要放热,据此判断;
(2)图象分析可知是1molN2与和3molH2完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,据此写出反应的热化学方程式;
(3)①依据盖斯定律计算反应热;
②已知①CH4(g)+202(g)=CO2 (g)+2H2O(l)△H1=-890.3kJ/mol;
②C(石墨,s)+O2(g)=CO2(g)△H2=-393.53kJ/mol;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ/mol;
由盖斯定律可知,②+2×③-①可得C(石墨,s)+2H2(g)═CH4(g)△H4.
解答 解:(1)图象分析生成物能量高于反应物可知为吸热反应,则根据图象该反应的热化学方程式为:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,
A、将反应的反应物与生成物弄反了,故A错误;
B、生成物的能量比反应物的能量高,故该反应为吸热反应,故B正确;
C、生成物的能量比反应物的能量高,故该反应为吸热反应,故C错误;
D、水由气态变为液态放热,所以该反应吸热减少,其反应热的值小于41kJ•mol-1,故D正确;
故选:BD;
(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1;
(3)①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
依据盖斯定律$\frac{(①-②)}{2}$得:2Li(s)+I2(s)═2LiI(s),所以△H=$\frac{1}{2}$(△H1-△H2),
故答案为:$\frac{1}{2}$(△H1-△H2);
②已知①CH4(g)+202(g)=CO2 (g)+2H2O(l)△H1=-890.3kJ/mol,
②C(石墨,s)+O2(g)=CO2(g)△H2=-393.53kJ/mol,
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ/mol,
由盖斯定律可知,②+2×③-①可得C(石墨,s)+2H2(g)═CH4(g)△H4=-393.53kJ/mol+2×(-285.8kJ/mol)-(-890.3kJ/mol)=-74.8 kJ/mol,
故答案为:-74.8 kJ/mol.
点评 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,注意键能计算焓变的方法,题目难度中等,注重基础知识的考查.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
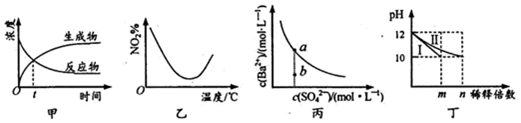
| A. | 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态 | |
| B. | 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)?N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O | |
| C. | 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点 | |
| D. | 图丁表示分别稀释l0mLpH均为12的NaOH和NH3•H2O溶液时pH的变化,曲线I表示NH3•H2O溶液,n>100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | B. | pH增大2个单位 | ||
| C. | 溶液中c(OH-)减小 | D. | Kw减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 停止北方冬季供暖,减少有害物质排放 | |
| B. | 寻找新能源,减少化石燃料的使用 | |
| C. | 退耕还林,改善生态环境 | |
| D. | 对锅炉和汽车等产生的有害气体和烟尘等进行处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收废旧电池的首要原因是回收石墨 | |
| B. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| C. | 焚烧一次性饭盒可减少白色污染 | |
| D. | 燃煤时加适量的生石灰可减少二氧化硫的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止白色污染应回收废旧塑料并加以焚烧 | |
| B. | 手机壳上贴的碳纤维膜是一种新型无机非金属材料 | |
| C. | 当今雾霾天气频发是由于人类活动对自然环境的影响所造成的 | |
| D. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| D. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com