
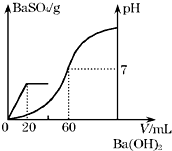
 有H2SO4和HCl的混合溶液20mL,在溶液中加入0.025mol?L-1的Ba(OH)2溶液,生成的BaSO4的量和相对应的溶液的pH如图所示,求解下列问题:
有H2SO4和HCl的混合溶液20mL,在溶液中加入0.025mol?L-1的Ba(OH)2溶液,生成的BaSO4的量和相对应的溶液的pH如图所示,求解下列问题:| n |
| V |
| 0.0005mol |
| 0.02L |
| 0.002mol |
| 0.02L |
| 0.1mol/L×0.02l |
| 0.02L+0.02L |


科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:038
有H2SO4和HCl的混合液20 mL,加入0.025mol·L-1 Ba(OH)2溶液时,生成沉淀的质量W(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示.(C点时混合液pH=7),求:
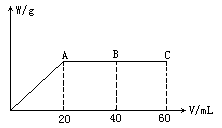
(1)原混合液中H2SO4和HCl的物质的量浓度.
(2)A点和B点时溶液的pH.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038

⑴最初混合溶液中H2SO4和盐酸的物质的量浓度;
⑵当加入Ba(OH)2体积分别为20 mL和40 mL时,溶液的pH各为多少?(lg5=0.69,lg6=0.78)
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058

(1)最初混合溶液中H2SO4和盐酸的物质的量浓度;
(2)当加入Ba(OH)2体积分别为20mL和40mL时,溶液的pH各为多少?(1g5=0.69,lg6=0.78)
@维生素C是一种水溶性维生素(pH<7),化学式为C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。它易被空气中的O2氧化,在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中含量在500mg×L-1左右。校外活动小组测定了某牌子的橙汁中维生素C的含量,下面是实验报告单,请填写。
(1)测定目的:测定××牌橙汁维生素C的含量
(2)测定原理:C6H8O6+Ⅰ2![]() C6H6O6+2H++2I-
C6H6O6+2H++2I-
(3)实验用品及试剂:
①仪器和用品:自选(略)
②试剂:指示剂________(填名称),7.50´10-3mol×L-1标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的________(填部位),右手摇动锥形瓶,眼睛注视________直到滴定终点。滴定至终点的现象是________。
(5)数据记录与处理。(设计数据记录和数据处理的表格,不必填数据)若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg×L-1。
(6)问题讨论:
①滴定时能否剧烈摇动锥形瓶?为什么?答:____________________。
②从分析数据看,此软包装橙汁是不是纯天然橙汁?答:______(填编号)
|
A.是 |
B.可能是 |
C.不是 |
制造商可能采取的做法是______。
|
A.加水稀释天然橙汁 |
B.橙汁已被浓缩 |
C.将维生素C作为添加剂 |
对于上述做法,你的意见是______。
|
A.同意 |
B.不同意 |
C.调查后再作结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
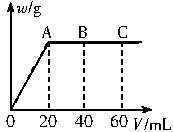
有H2SO4和HCl的混合溶液20mL,加入0.025mol?L-1Ba(OH)2溶液时,生成沉淀的质量w(g)和加入Ba(OH)2溶液的体积V(mL)的关系如下图所示(C点混合液pH=7),求:
(1)原混合液中H2SO4和HCl的物质的量浓度。
(2)A点和B点时溶液的pH。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com