
下列离子或分子组能大量共存,且满足相应要求的是
( )。
| 选项 | 离子或分子 | 要求 |
| A | K+、NO3-、Cl-、HCO3- | c(K+)<c(Cl-) |
| B | Ca2+、NO3-、SO32-、Cl- | 滴加盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、Br- | 逐滴滴加NaOH溶液立即有气体产生 |
| D | Na+、HCO3-、Mg2+、SO42- | 滴加氢氧化钠溶液立即有沉淀产生 |
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a ,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属全部溶解,则溶液中一定含有Fe3+
B.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式书写正确的是( )。
A.稀硝酸和过量铁屑反应:Fe+4H+ +NO3-===Fe3++NO↑+2H2O
+NO3-===Fe3++NO↑+2H2O
B.向硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4 ++OH-===NH3↑+H2O
++OH-===NH3↑+H2O
C.氯化铝溶液中加入过量氨水:A l3++4NH3·H2O===AlO2-+4NH4++2H2O
l3++4NH3·H2O===AlO2-+4NH4++2H2O
D.H2C2O4使酸性KMnO4溶液褪色:5H2C2O4+6H++2MnO4-===10CO2↑+
2Mn2++8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
A.增大压强 B.升高温度 C.增大CO的浓度 D.分离出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:
请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0g【已知有关摩尔质量:M(Cu)=64g/mol, M(CuSO4·5H2O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
 |
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42-===BaSO4↓”来表示,请写出有关反 应的化学方程式(3个):
应的化学方程式(3个):
①_________________________________________ _____________________;
_____________________;
②______________________________________________________________;
③_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它 易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是 ( )。
易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是 ( )。
A.S2Cl2既作氧化剂又作还原剂B.氧化产物与还原产物物质的量之比为3∶1
C.每生成1 mol SO2转移4 mol电子
D.H2O作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的最高正价与其负价的绝对值之差为4,该元素的离子与跟其核外电子排布相
同的离子形成的化合物是( )
A K2S B MgO C MgS D NaF
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是 ( )。
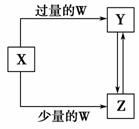
| 选项 | A | B | C | D |
| X | C | Fe | Ca(OH)2溶液 | AlCl3 |
| W | O2 | HNO3 | CO | NH3·H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com