
| A. | Na+、Ca2+、Cl-、HCO3- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | K+、Na+、NO3-、MnO4- | D. | NH4+、Al3+、NO3-、OH- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| B. | 1.0 mol•L-1Na2C2O4溶液:c(OH-)=c(HC2O4-)+c(H+)+c(H2C2O4) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1NaOH溶液等体积混合后,溶液pH大于7,则反应后的混合液中:c(OH-)+c(A-)=c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CS2熔点高于CO2,其原因是者都为分子晶体,相对分子质量越大,分子间作用力越大
CS2熔点高于CO2,其原因是者都为分子晶体,相对分子质量越大,分子间作用力越大查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂B | 湿润的试纸A | 现象 | 结论 |
| A | 氯水 | pH试纸 | 先变红后褪色 | 氯水具有酸性和漂白性 |
| B | 浓氨水、生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | Na2SO3、硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| D | MnO2、浓盐酸 | 淀粉KI试纸 | 变蓝 | 氧化性:Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、HD、C3H8 | B. | P2O5、CO2、H3PO4 | C. | SO2、SiO2、CS2 | D. | CCl4、(NH4)2S、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②④ | C. | ②③ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
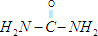 .
.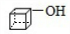 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com