
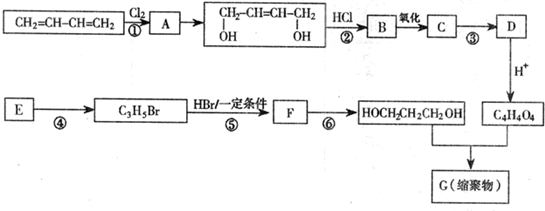
分析 1,3-丁二烯与氯气发生1,4-加成反应生成A为ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH=CHCH2OH,与HCl发生加成反应生成B为HOCH2CH2CHClCH2OH.D酸化得到C4H4O2,D为盐,则C4H4O2为HOOC-CH=CH-COOH,故B发生催化氧化生成C为HOOCCH2CHClCOOH,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,则D为NaOOC-CH=CH-COONa.
E是一种石油裂解气,能使酸性高锰酸钾溶液褪色,含有不饱和键,同温同压下,E的密度是H2的21倍,E的相对分子质量为42,则E为CH3CH=CH2,结合转化关系可知,E与溴发生取代反应生成C3H5Br,其结构为BrCH2CH=CH2,与HBr发生加成反应生成F为BrCH2CH2CH2Br,F在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2CH2OH,与HOOC-CH=CH-COOH通过酯化反应进行的缩聚反应生成高聚物G为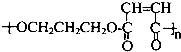 ,以此解答该题.
,以此解答该题.
解答 解:1,3-丁二烯与氯气发生1,4-加成反应生成A为ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH=CHCH2OH,与HCl发生加成反应生成B为HOCH2CH2CHClCH2OH.D酸化得到C4H4O2,D为盐,则C4H4O2为HOOC-CH=CH-COOH,故B发生催化氧化生成C为HOOCCH2CHClCOOH,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,则D为NaOOC-CH=CH-COONa.
E是一种石油裂解气,能使酸性高锰酸钾溶液褪色,含有不饱和键,同温同压下,E的密度是H2的21倍,E的相对分子质量为42,则E为CH3CH=CH2,结合转化关系可知,E与溴发生取代反应生成C3H5Br,其结构为BrCH2CH=CH2,与HBr发生加成反应生成F为BrCH2CH2CH2Br,F在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2CH2OH,与HOOC-CH=CH-COOH通过酯化反应进行的缩聚反应生成高聚物G为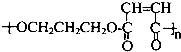 ,
,
(1)E是一种石油裂解气,能使酸性高锰酸钾溶液褪色,含有不饱和键,同温同压下,E的密度是H2的21倍,E的相对分子质量为42,则分子中最大C原子数目为$\frac{42}{12}$=3…6,故分子式为C3H6,核磁共振氢谱显示E有3种不同化学环境的氢原子,其个数比为1:2:3,H原子数目分别为1、2、3,含有1个甲基,则E为CH3CH=CH2,
故答案为:CH2=CH-CH3;
(2)E与溴发生取代反应生成C3H5Br,其结构为BrCH2CH=CH2,与HBr发生加成反应生成F为BrCH2CH2CH2Br,故答案为:加成反应;
(3)BrCH2CH2CH2Br在氢氧化钠水溶液中加热条件下可水解生成HOCH2CH2CH2OH,故答案为:NaOH/水溶液;
(4)HOCH2CH=CHCH2OH中含有C=C双键,氧化羟基时也可以氧化C=C双键,转化生成E为HOOCCH=CHCOOH,E中含有C=C双键,故反应②③的目的是:保护碳碳双键,防止被氧化,
故答案为:防止碳碳双键被氧化;
(5)反应⑤的化学方程式为 CH2=CHCH2Br+HBr$\stackrel{一定条件}{→}$CH2Br-CH2-CH2Br,
故答案为:CH2=CHCH2Br+HBr$\stackrel{一定条件}{→}$CH2Br-CH2-CH2Br;
(6)B被氧化成C的过程中,可能氧化不完全会有中间产物生成,该中间产物可能是HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH,可以通过检验醛基确定该物质是否存在,使用试剂为新制氢氧化铜悬浊液或银氨溶液,
故答案为:HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH; 新制氢氧化铜悬浊液(或银氨溶液).
点评 本题主要考查有机物的推断与合成,为高考常见题型,侧重考查学生的分析能力,涉及常见有机反应类型,包括加成反应、卤代烃的水解、醇的氧化、卤代烃的消去、烃的卤代、缩聚反应等,全面考查有机物基础知识,掌握官能团的性质与转化是关键,有机框图题的解答要充分利用题给信息,通过对比反应前后物质结构上的差异推断反应原理,对学生的逻辑推理有一定的要求,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 当容器内反应物和产物共存且浓度比等于化学计量数比时,反应达到平衡状态 | |
| B. | 达平衡后再通入NH3,则平衡正向移动,NH3转化率减小 | |
| C. | 达平衡后升温,则逆反应速率加快,正反应速率减慢,平衡逆向移动 | |
| D. | 达平衡后若扩大容器体积,平衡正向移动,氮气浓度变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫的突出贡献是发现元素周期律 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| D. | 在周期表中,在金属与非金属的分界线附近寻找半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4<HBrO4<HClO4 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是用来电解CuCl2溶液的装置图,在U形管中注入CuCl2溶液,插入A.B两根石墨棒作电极.回答下列问题:
如图是用来电解CuCl2溶液的装置图,在U形管中注入CuCl2溶液,插入A.B两根石墨棒作电极.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子里含有碳碳三键的不饱和链烃叫炔烃 | |
| B. | 炔烃分子里的所有碳原子都在同一直线上 | |
| C. | 炔烃易发生加成反应,也易发生取代反应 | |
| D. | 炔烃不能使溴水褪色,但可以使高锰酸钾酸性溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下发生分解反应 | B. | 可以在空气中燃烧 | ||
| C. | 光照条件下与Cl2发生取代反应 | D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com