
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1和表(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
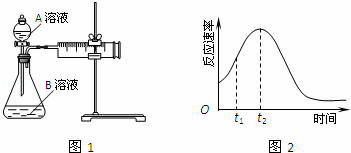
(1)写出草酸溶于水的电离方程式: .
(2)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:① ②(填:>、<、=).
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(5)小组同学发现反应速率总是如2图,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、② .
| 探究影响化学反应速率的因素. | |
| 专题: | 化学反应速率专题. |
| 分析: | (1)多元弱酸分步电离,据此书写电离方程式; (2)对比①②实验可探究草酸浓度对化学反应速率的影响,②中A溶液的浓度比①中大; (3)先求出反应的n(MnO4﹣)的物质的量,再求出反应后的浓度; (4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率; (5)根据反应过程中放出的热量导致反应速率加快还可能是:反应中催化剂影响反应速率. |
| 解答: | 解:(1)草酸是二元弱酸,分两步电离,电离方程式为:H2C2O4⇌H++HC2O4﹣,HC2O4﹣⇌H++C2O42﹣; 故答案为:H2C2O4⇌H++HC2O4﹣,HC2O4﹣⇌H++C2O42﹣; (2)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大, 故答案为:浓度;<; (3)CO2的物质的量为: 2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 2 10 x 0.0002mol 解得 x=0.00004mol 反应剩余的高锰酸根离子的物质的量为:30×10﹣3L×0.01mol•L﹣1﹣0.00004mol=0.00026mol c(MnO4﹣)= 故答案为:5.2×10﹣3; (4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率, 故答案为:KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间; (5)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,②产物Mn2+是反应的催化剂, 故答案为:产物Mn2+(或MnSO4)是反应的催化剂. |
| 点评: | 本题考查了影响化学反应速率的因素,难度中等,注意掌握影响化学反应速率的因素,明确探究影响化学反应速率因素的方法. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某离子晶体晶胞结构如图(●)X位于立方体的顶点,(○)Y位于立方体的中心。

(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX为________(填角的度数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
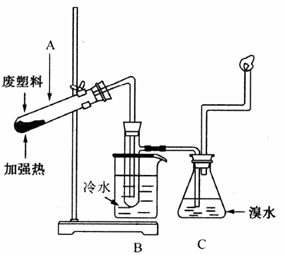
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示。加热聚丙烯废塑料得到的产物如下表所示:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 炭 |
| 质量分数(%) | 12 | 24 | 12 | 16[ | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
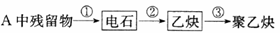
写出反应②、③的化学方程式_____________________。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有_________种。
(3) 锥形瓶C中观察到的现象是___________,经溴水充分吸收后,剩余气体经干燥后平均相对分子质量为___________。
(4) 写出C中逸出的气体在工业上的两种用途_________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为解决能源危机,在汽油中掺入一定比例的乙醇(即“乙醇汽油”),以代替一部分汽油.乙醇在气缸中完全燃烧的热化学方程式为: C2H5OH(l)+
C2H5OH(l)+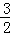 O2(g)=CO2(g)+
O2(g)=CO2(g)+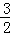 H2O(l)△H1=﹣683.4kJ/mol.下列说法正确的是( )
H2O(l)△H1=﹣683.4kJ/mol.下列说法正确的是( )
|
| A. | 该反应过程中,断裂化学键会放出热量 |
|
| B. | 该反应中,生成物的总能量大于反应物的总能量 |
|
| C. | 乙醇的燃烧热为683.4 kJ/mol |
|
| D. | 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是
( )
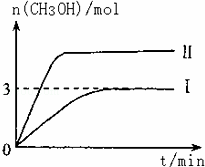
|
| A. | 曲线II对应的条件改变是减小压强 |
|
| B. | 若T2°C时上述反应的平衡常数为0.42,则T2<T1 |
|
| C. | 在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
|
| D. | 在T10C,若起始时向容器中通入4.5molCO2、6mol H2,平衡时容器内的压强P1=P/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是( )
A.X=Y=Z B.X>Y=Z
C.X<Y=Z D.X=Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
下列浓度关系正确的是( )
A.氯水中:c(Cl2)=2
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠溶液与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO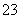 )>c(OH-)>c(HCO
)>c(OH-)>c(HCO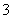 )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据相似相溶规则和实际经验,下列叙述不正确的是( )
A.白磷(P4)易溶于CS2,但难溶于水
B.NaCl易溶于水,难溶于CCl4
C.碘易溶于苯,微溶于水
D.卤化氢易溶于水,也易溶于CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下向饱和Na2SO4溶液中加入ag无水硫酸钠粉末,搅拌,静置后析出bg Na2SO4·10H2O晶体,(b-a)g是
A.原饱和溶液失去的水的质量
B.原饱和溶液中减少的硫酸钠的质量
C.原饱和溶液中失去的水和硫酸钠的总质量
D.析出的晶体含有的硫酸钠的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com