
| 2.4g |
| 64g/mol |
| 3 |
| 40 |
| 3 |
| 40 |
| ||
| 2 |
| 3 |
| 40 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
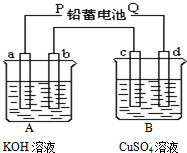 如图装置实验,A、B两烧杯分别盛放200g10%KOH和足量CuSO4溶液.通电一段时间后,c极增重3.2g.
如图装置实验,A、B两烧杯分别盛放200g10%KOH和足量CuSO4溶液.通电一段时间后,c极增重3.2g.查看答案和解析>>
科目:高中化学 来源: 题型:
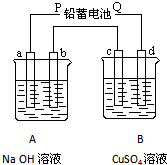
 如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:
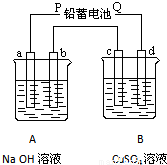
如图装置实验a为铁电极,b、c、d为石墨电极,A、B两烧杯分别盛放200g10%NaOH和足量3 LCuSO4溶液。通电一段时间后,c极上有Cu析出, 请回答下列问题:

(1)电源P极为 极; b电极和c电极上发生的电极反应式: ;
(2)B烧杯中电解反应的离子方程式 ;若测得A杯中溶液的质量减少2.7g(不考虑水的蒸发、烧杯内溶液体积的变化)。电解后a电极上产生的气体的体积 (标准状况),B烧杯中溶液的pH 。
(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e- 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
假设在a极制得气体0.050mol,这时电池内消耗的H2SO4的物质的量至少是 。
查看答案和解析>>
科目:高中化学 来源:2008-2009学年浙江省宁波市高三(上)期末化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com