
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
分析 (1)先根据溶液中电荷守恒计算氢离子的浓度,然后求出pH;
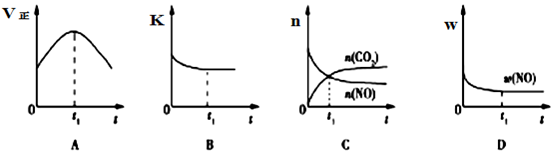
(2)①根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②依据反应自发进行的条件是△H-T△S<0分析判断;
(3)A、到达平衡后正、逆速率相等,不再变化;
B、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D、到达平衡后各组分的含量不发生变化;
(4)由表中数据可知,C、NO、E、F的化学计量数之比为(3.000-2.960):(0.10-0.020):0.040:0.040=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
①计算各气体的平衡浓度,代入平衡常数表达式计算;
②若T1<T2,温度升高NO浓度增大,平衡逆向进行;
③反应C+2NO?N2+CO2是一个气体体积不变的反应,而反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡.
解答 解:(1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性;试样的pH值根据溶液中电荷守恒:c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)计算H+离子浓度为10-4,该样本的pH=4,
故答案为:4;
(2)①N2(g)+O2(g)?2NO(g)△H>0恒温,恒容密闭容器中,
A.反应前后气体质量不变,体积不变,混合气体的密度始终不变化,不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量不变,气体物质的量不变,混合气体的平均相对分子质量始终不变化,不能说明反应达到平衡状态,故B错误;
C.N2、O2、NO的物质的量之比为1:1:2 不能说明正逆反应速率相同,故C错误;
D.氧气的百分含量不再变化是平衡标志,故D正确;
故答案为:D;
②2CO(g)=2C(s)+O2(g)已知该反应的△H>0,反应是焓变增大,熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;
故答案为:不能;
(3)A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:BD;
(4)由表中数据可知,C、NO、E、F的化学计量数之比为(3.000-2.960):(0.10-0.020):0.040:0.040=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,反应方程式为C+2NO?N2+CO2,
①平衡时c(NO)=$\frac{0.020mol/L}{2l}$=0.010mol/L,c(N2)=c(CO2)=$\frac{0.04mol}{2L}$=0.020mol/L,故T1℃时该反应的平衡常数为K1=$\frac{0.020×0.020}{0.01{0}^{2}}$=4,
故答案为:4;
②T1<T2,图表中NO随温度升高增大,说明升温平衡逆向进行,正反应为放热反应,该反应△H<0,
故答案为:<;
③反应C+2NO?N2+CO2是一个气体体积不变的反应,而反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为 $\frac{0.10-0.020}{0.10}$×100%=80%,则达到新平衡时NO的转化率为80%,
故答案为:80%.
点评 该题综合考查化学反应原理的基础知识,涉及离子的水解、pH值的计算、化学平衡常数的计算、自由能的应用等,题目难度中等,注意相关知识的积累.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (写出其中一种的结构简式).
(写出其中一种的结构简式).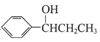 的合成路线
的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
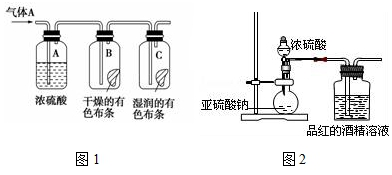
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com