
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
| 投料Ⅱ | 0.5mol/L | 1.5mol/L | 1.0mol/L |
分析 (1)已知25℃时:①N2(g)+O2(g)?2NO(g)△H=+183kJ/mol
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol
③4NH3(g)+5O2(g)?4NO(g)+6H2O(l)△H=-1164.4kJ/mol
根据盖斯定律①+②×$\frac{3}{2}$-$\frac{1}{2}$×③进行计算;
(2)①根据合成氨反应的平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积;
②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以平衡时H2的浓度为3.0mol/L×(1-40%)=1.8mol/L,据此分析;
③由(1)得出合成氨为放热反应,所以升高温度平衡向逆反应方向移动,据此分析反应的化学平衡常数变化;
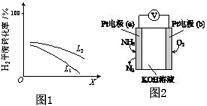
④i、由图可知,X越大,氢气转化率越低;
ii、由N2(g)+3H2(g)?3NH3(g)△H<0,压强大高,氢气转化率大;
(3)Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原,结合电极方程式解答该题.
解答 解:(1)已知25℃时:①N2(g)+O2(g)?2NO(g)△H=+183kJ/mol
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol
③4NH3(g)+5O2(g)?4NO(g)+6H2O(l)△H=-1164.4kJ/mol
根据盖斯定律①+②×$\frac{3}{2}$-$\frac{1}{2}$×③得,N2(g)+3H2(g)?3NH3(g)△H=+183-571.6×$\frac{3}{2}$+$\frac{1}{2}$×1164.4=-92.2kJ/mol,故答案为:-92.2KJ/mol;
(2)①因为合成氨反应的平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积,所以N2(g)+3H2(g)?3NH3(g)的平衡常数表达式为K=$\frac{c(N{H}_{3})^{2}}{c({N}_{2})c({H}_{2})^{3}}$,故答案为:K=$\frac{c(N{H}_{3})^{2}}{c({N}_{2})c({H}_{2})^{3}}$;
②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以按投料Ⅱ进行反应平衡时H2的浓度也为3.0mol/L×(1-40%)=1.8mol/L,所以按投料Ⅱ进行反应,起始时反应进行的方向为正向,故答案为:正向;
③由(1)得出合成氨为放热反应,所以升高温度平衡向逆反应方向移动,所以反应的化学平衡常数变小,故答案为:变小;
④i、由图可知,X越大,氢气转化率越低,升高温度平衡向逆反应方向移动,则氢气转化率减小,则X表示温度,故答案为:温度;
ii、由N2(g)+3H2(g)?3NH3(g)△H<0,温度高,氢气转化率小,压强大,平衡正向移动,氢气转化率大,图中等温度时L2对应的氢气转化率大,则压强L1<L2,故答案为:L1<L2;
(3)①Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原发生还原反应,故答案为:还原;
②因为a极为负极,负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了盖斯定律的应用、化学平衡影响因素分析判断、平衡常数的应用等,题目难度较大,侧重于考查学生对基础知识的综合应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 | |
| 步骤3:静置后取上清液,加入BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液(Ba(OH)2):用K2SO4溶液 | B. | NaCl溶液(Na2SO4):用Ba(NO3)2溶液 | ||
| C. | KOH溶液K2CO3:用CaCl2溶液 | D. | HNO3溶液(HCl):用AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的硬度往往大于它的纯金属 | B. | 合金的熔点高于它的成分金属 | ||
| C. | 青铜是我国使用最早的合金 | D. | 钢是使用量最大,用途最广的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加Zn片质量 | B. | 增加盐酸的体积 | ||
| C. | 滴加几滴CuSO4溶液 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用惰性电极电解熔融的MgO可制得Mg | |
| B. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| C. | 草木灰可与铵态氮肥混合施用 | |
| D. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
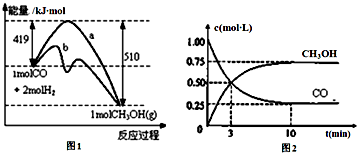 工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol
工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com