
| A. | 原电池的正极和电解池的阴极所发生的反应分别是氧化反应、还原反应 | |
| B. | 温度不变,用惰性电极电解饱和碳酸钠溶液,通电一段时间,溶液的浓度不变,有晶体析出 | |
| C. | 用惰性电极电解CuCl2溶液,一段时间后,要恢复原来的浓度,应加入固体CuSO4 | |
| D. | 以惰性电极电解CuSO4溶液,若阳极上产生的气体的物质的量为0.010mol,则阴极上析出Cu的质量为12.8g |
分析 A、原电池的正极和电解池的阴极都发生还原反应;
B、电解饱和碳酸钠溶液相对于电解水,电解水生成氢气和氧气不能与碳酸钠反应;
C、电解氯化铜溶液时生成氯气和Cu;
D、惰性电极电解CuSO4的溶液,溶液中的阴离子向阳极移动,在阳极上放电,利用离子的放电顺序来确定阳极上产生的气体是氧气,根据电子守恒来确定阴极上析出金属铜的量的多少.
解答 解:A、原电池的正极发生还原反应,故A错误;
B、电解饱和碳酸钠溶液相对于电解水,电解水生成氢气和氧气不能与碳酸钠反应,所以温度不变时用惰性电极电解饱和碳酸钠溶液,通电一段时间,溶液的浓度不变,有晶体析出,故B正确;
C、电解氯化铜溶液时生成氯气和Cu,用惰性电极电解CuCl2溶液,一段时间后,要恢复原来的浓度,应加入固体CuCl2,故C错误;
D、惰性电极电解CuSO4的溶液,阳极上的反应为:4OH-→4H2O+O2↑+4e-,当阳极上产生的气体的物质的量为0.0100mol,转移电子是:0.0400mol,阴极上的电极反应为:Cu2++2e-═Cu,当转移电子是0.0400mol时,析出Cu的质量m=0.0200mol×64g/mol=1.28g,故D错误;
故选B.
点评 本题考查学生电解池的工作原理知识,注意电子守恒思想在解题中的应用,可以根据教材知识来回答,难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 混合体系 | 溴水 | 酒精与水 | 固体碘和氯化铵 | 混有少量KCl的KNO3粉末 |
| 分离方法 | 萃取、分液 | 加生石灰,蒸馏 | 加热 | 配成热的饱和溶液、降温结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH变大 | |
| B. | c(Na+)与c(SO42-)的比值不变 | |
| C. | 电解过程中,向阳极附近溶液滴入酚酞,溶液变为红色 | |
| D. | 阴、阳极产生气体在相同条件下体积之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
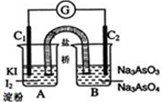 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4 | B. | C2H6 | C. | C2H2 | D. | C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
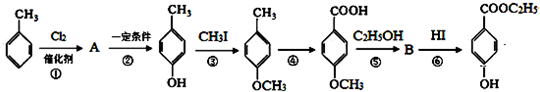
 .
.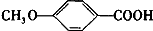 +C2H5OH$?_{△}^{浓硫酸}$
+C2H5OH$?_{△}^{浓硫酸}$ +H2O.
+H2O.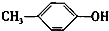 +CH2I→
+CH2I→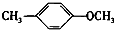 +HI.
+HI.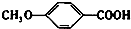 的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.
的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
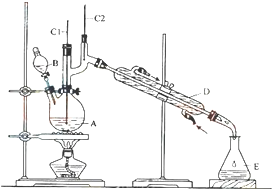 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:| 沸点/0C | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com