

| A、维生素B3 |
| B、阿司匹林 |
| C、芬必得 |
| D、扑热息痛 |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
 CaTiO3晶胞如图所示,图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点,则晶体中每个Ti4+紧邻等距离最近的O2-有( )个.
CaTiO3晶胞如图所示,图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点,则晶体中每个Ti4+紧邻等距离最近的O2-有( )个.| A、4 | B、6 | C、8 | D、12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
222 86 |
| A、Rn的原子核内含有222个中子 |
| B、Rn位于元素周期表中第六周期ⅦA族 |
| C、Rn的化学性质不活泼,因此与任何物质都不能反应 |
| D、新铺大理石地面的居室,需常开窗换气,以减少氡对人体的危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、金刚石的正四面体网状结构中最小的环上有6个碳原子 |
| B、在氯化钠晶体中,每个氯离子周围都紧邻8个钠离子 |
| C、如图在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子 |
| D、分子晶体干冰也是面心立方晶胞,每个晶胞平均含有4个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验目的 | 实验操作 |
| A | 验证SO2具有漂白性 | 将SO2通入品红溶液中,品红溶液褪色 |
| B | 验证Fe2+的还原性 | FeCl2溶液中加入酸性KMnO4溶液,KMnO4溶液褪色 |
| C | 检验尿液中是否含有葡萄糖 | 在尿液中加新制的Cu(OH)2悬浊液加热至沸腾 |
| D | 验证Na2CO3溶液中存在水解平衡 | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的名称是
的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
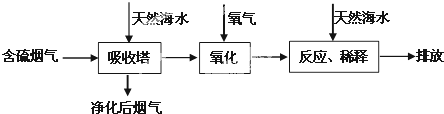
| 难溶 电解质 |
AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com