
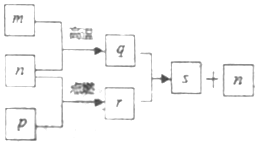
 短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 36g物质q与过量的物质r反应则有2mol电子发生转移 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
分析 短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,故Y为氧元素;m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体,故为氯气,则元素W为Cl元素;而由于Z与X处于同一主族,且必须有一种是金属元素,且元素X的原子序数小于8,而根据物质的转化关系图可知,氯气能在单质n中燃烧,故n为H2,则元素X为H元素,而元素Z与H元素同主族,且原子序数大于8小于17,故为Na元素,据此分析.
解答 解:短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素.Y元素在大气中存在两种常见单质,故Y为氧元素;m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体,故为氯气,则元素W为Cl元素;而由于Z与X处于同一主族,且必须有一种是金属元素,且元素X的原子序数小于8,而根据物质的转化关系图可知,氯气能在单质n中燃烧,故n为H2,则元素X为H元素,而元素Z与H元素同主族,且原子序数大于8小于17,故为Na元素.
即X为H元素,Y为O元素,Z为Na元素,W为Cl元素,则m为金属钠,n为H2,p为Cl2,则q为NaH,r为HCl,s为NaCl.
A、化合物Z2Y2与X2Y2分别为过氧化钠和双氧水,过氧化钠为离子化合物,含离子键和共价键,而双氧水为共价化合物,只含共价键,故含有的化学键类型不同,故A错误;
B、由于水分子间有氢键,故水分子的沸点高于HCl,故B正确;
C、36gNaH的物质的量为1.5mol,而NaH与HCl的反应为归中反应,当1molNaH反应时,反应转移1mol电子,故1.5molNaH转移1.5mol电子,故C错误;
D、由O、Na、Cl三元素组成的化合物可能为NaClO或NaClO3或NaClO4,由于NaClO3或NaClO4是强酸强碱盐,故溶液显中性,但NaClO是强碱弱酸盐,故溶液显碱性,故D错误.
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,应注意氢键对物质的熔沸点的影响,难度中等,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 | |
| B. | 用KSCN溶液鉴别Fe3+和Fe2+ | |
| C. | 用NaOH溶液和红色石蕊试纸鉴别溶液是否含NH4+ | |
| D. | 在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
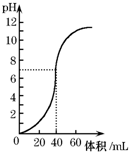 用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
用1.0mol•L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )| A. | 1mol•L-1,60mL | B. | 0.5mol•L-1,80mL | C. | 0.5mol•L-1,40mL | D. | 1mol•L-1.80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉生产车间应严禁烟火 | |
| B. | 含Cl2的尾气用碱溶液处理后再排放 | |
| C. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com