
分析 明确电解质的强弱,强电解质完全电离,用等号,弱电解质部分电离,用可逆号,注意电离方程式书写遵循原子个数、电荷守恒规律.
解答 解:氯化钾为强电解质,完全电离,电离方程式:KCl=K++Cl-;
故答案为:KCl=K++Cl-;
硫酸钠为强电解质,完全电离,电离方程式:Na2SO4=2Na++SO42-;
故答案为:Na2SO4=2Na++SO42-;
氯化钡为强电解质,完全电离,电离方程式:BaCl2=Ba2++2Cl-;
故答案为:BaCl2=Ba2++2Cl-;
硫酸氢钠强电解质,水溶液中完全电离出钠离子、氢离子、硫酸根离子,电离方程式:NaHSO4=Na++H++SO42-;
故答案为:NaHSO4=Na++H++SO42-;
碳酸氢钠强电解质,水溶液中完全电离出钠离子、碳酸氢根离子,电离方程式:NaHCO3=Na++HCO3-;
故答案为:NaHCO3=Na++HCO3-.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意碳酸氢根为弱酸的酸式根离子,不能拆,题目难度不大.


科目:高中化学 来源: 题型:解答题
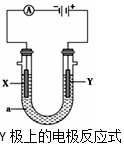 电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:
电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO4 2-、HCO3 - | B. | Cu2+、K+、SO4 2-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO4 2-、Cl - |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
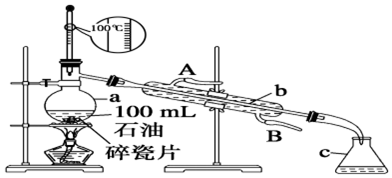
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO中毒者转移到通风处抢救 | |
| B. | 皮肤上不慎沾有浓碱液,立即用大量水冲洗,然后涂上2% 的硼酸溶液 | |
| C. | 少量酒精失火时,立即用湿抹布盖灭 | |
| D. | 夜间进入厨房,闻到很浓的煤气味,立即开灯检查 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75 Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中的平衡常数均为36 | |
| B. | 向容器①中通入氦气,平衡时A的转化率不变 | |
| C. | 容器②中达到平衡时放出的热量为0.05 Q kJ,达到平衡时,两个容器中C的物质的量浓度均为1.5 mol•L-1 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的特征是元素化合价发生了变化 | |
| B. | 在水溶液中能电离出H+的化合物不一定是酸 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定不相同 | |
| D. | 因为NH3溶于水的溶液能导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
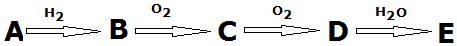
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com