
| A. | CH3-CH2-NO2和H2N-CH2-COOH互为同分异构体 | |
| B. | H、D、T互为同位素 | |
| C. | O2和O3互为同素异形体 | |
| D. | CH3CH2CH2CH3与 性质完全相同 性质完全相同 |
分析 A.同分异构体指分子式相同结构不同的化合物;
B.质子数相同中子数不同的同一元素的不同原子互称同位素;
C.同素异形体是同种元素组成的性质不同的单质之间的互称;
D.CH3CH2CH2CH3与 结构不同.
结构不同.
解答 解:A.CH3-CH2-NO2和H2N-CH2-COOH分子式相同,结构不同互为同分异构体,故A正确;
B.H、D、T质子数相同中子数不同,互为同位素,故B正确;
C.O2和O3是同种氧元素组成的性质不同的单质,互称同素异形体,故C正确;
D.二者虽互为同分异构体,但结构不同,性质有所不同,故D错误.
故选D.
点评 本题考查同系物、同分异构体、同位素、同素异形体、同一物质的区别,难度不大,注意把握概念的内涵与外延.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
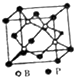 硼及其化合物在耐高潮合金工业、催化剂制造、高能燃料等方面有广泛应用.
硼及其化合物在耐高潮合金工业、催化剂制造、高能燃料等方面有广泛应用. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
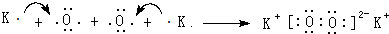 (用元素符号表示).
(用元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
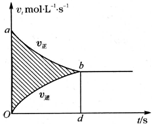 过程中以B的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示为( )
过程中以B的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示为( )| A. | c(B)减少 | B. | n(B)减少 | C. | c(B)增加 | D. | n(B)增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
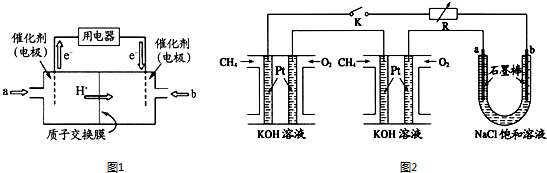
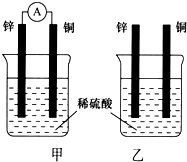 分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表.请回答下列问题:
分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解产物在应用中都只能作为氧化剂 | |
| B. | 电解一段时间后,溶液pH不变 | |
| C. | 阳极反应:3H2O-6e-═O3+6H+ | |
| D. | 每生成1 mol O3转移电子数为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{b}$ | B. | $\frac{a}{2b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{b}{a}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com