
| A. | 干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 | |
| B. | 化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键 | |
| C. | CH4和CCl4中,每个原子的最外层都具有8电子稳定结构 | |
| D. | NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 |
分析 A、干冰是分子晶体,而石英晶体是原子晶体;
B、化学反应的实质是断开旧化学键,形成新的化学键;
C、CH4分子中氢原子最外层达2电子的稳定结构;
D、NaHSO4晶体溶于水时,电离产生钠离子、氢离子和硫酸根离子.
解答 解:A、干冰是分子晶体,而石英晶体是原子晶体,而熔化时需克服微粒间的作用力分别是分子间作用力和共价键,故A错误;
B、化学反应的实质是断开旧化学键,形成新的化学键,所以化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键,故B正确;
C、CH4分子中氢原子最外层达2电子的稳定结构,不是8电子稳定结构,故C错误;
D、NaHSO4晶体溶于水时,电离产生钠离子、氢离子和硫酸根离子,所以NaHSO4晶体溶于水时,离子键被破坏,共价键也被破坏,故D错误;
故选B.
点评 本题考查晶体类型的判断,题目难度不大,注意晶体类型的分类和性质的区别.


科目:高中化学 来源: 题型:实验题
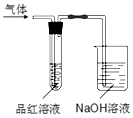 用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:
用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
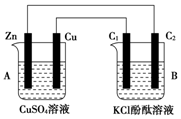 按图所示装置进行实验,并回答下列问题:
按图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中通入过量的二氧化碳CO2+OH?═HCO3- | |
| B. | 金属钠和水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2═2Fe3++O2↑+2H+ | |
| D. | 三氧化硫与氯化钡溶液生成沉淀的反应SO3+Ba2++H2O═BaSO4↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1molCl2全部溶于水形成的1L溶液中:2c(Cl2)+c(Cl-)+c(HClO)+c(ClO-)=0.2mol•L-1 | |
| B. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | 物质的量浓度均为0.1mol•L-1的NaClO与NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 室温下,向0.01mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
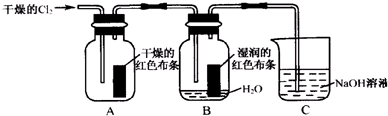
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2只作氧化剂,O2是还原产物 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 由上述方程式可知氧化性:Na2FeO4>Na2O2>O2 | |
| D. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制容器可盛装热的浓硫酸 | |
| B. | 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 | |
| C. | K与水反应比Li与水反应剧烈 | |
| D. | 用氢氧化钠溶液吸收二氧化氮时有一氧化氮生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com