
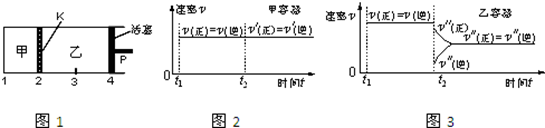
| A£® | ±£³ÖĪĀ¶ČŗĶ»īČūĪ»ÖĆ²»±ä£¬ŌŚ¼×ÖŠŌŁ¼ÓČė1 mol AŗĶ2 mol B£¬“ļµ½ŠĀµÄĘ½ŗāŗ󣬼×ÖŠCµÄÅØ¶ČŹĒŅŅÖŠ CµÄÅØ¶ČµÄ2±¶ | |
| B£® | ±£³Ö»īČūĪ»ÖĆ²»±ä£¬ÉżøßĪĀ¶Č£¬“ļµ½ŠĀµÄĘ½ŗāŗ󣬼ה¢ŅŅÖŠBµÄĢå»ż·ÖŹż¾łŌö¼Ó | |
| C£® | ±£³ÖĪĀ¶Č²»±ä£¬ŅĘ¶Æ»īČūP£¬Ź¹ŅŅµÄČŻ»żŗĶ¼×ĻąµČ£¬“ļµ½ŠĀµÄĘ½ŗāŗó£¬ŅŅÖŠCµÄĢå»ż·ÖŹżŹĒ¼×ÖŠCµÄĢå»ż·ÖŹżµÄ2±¶ | |
| D£® | ±£³ÖĪĀ¶ČŗĶŅŅÖŠµÄŃ¹Ēæ²»±ä£¬t2Ź±·Ö±šĻņ¼×”¢ŅŅÖŠ¼ÓČėµČÖŹĮæµÄŗ¤Ęųŗ󣬼ה¢ŅŅÖŠ·“Ó¦ĖŁĀŹ±ä»ÆĒéæö·Ö±šČēĶ¼2ŗĶĶ¼3ĖłŹ¾£Øt1Ē°µÄ·“Ó¦ĖŁĀŹ±ä»ÆŅŃŹ”ĀŌ£© |
·ÖĪö æŖŹ¼¼ÓČė4molCŗĶ2molDĻąµ±ÓŚĘšŹ¼¼ÓČė2molAŗĶ4molB£¬¼“ŅŅČŻĘ÷ÄŚµÄĘųĢåµÄĪļÖŹµÄĮæĪŖ¼×ČŻĘ÷ÄŚµÄĘųĢåµÄĪļÖŹµÄĮæµÄ2±¶£¬¶ųŅŅČŻĘ÷µÄĢå»żĪŖ¼×ČŻĘ÷µÄĢå»żµÄ2±¶£¬ŌŚĻąĶ¬ĪĀ¶ČĻĀ“ļµ½ĻąĶ¬Ę½ŗāדĢ¬£¬Ę½ŗāŹ±Ķ¬ÖÖĪļÖŹµÄÅضČĻąµČ£®
A£®±£³ÖĪĀ¶ČŗĶ»īČūĪ»ÖĆ²»±ä£¬ŌŚ¼×ÖŠŌŁ¼ÓČė1molAŗĶ2molB£¬ŌņĻąµ±ÓŚŌŚŌĄ“µÄ»ł“”ÉĻŌö“óŃ¹Ēæ£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬“ļµ½Ę½ŗāŹ±£¬¼×ÖŠCµÄÅØ¶ČŠ”ÓŚŌĄ“µÄ2±¶£»
B£®±£³Ö»īČūĪ»ÖĆ²»±ä£¬ÉżøßĮ½øöČŻĘ÷µÄĪĀ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£»
C£®±£³ÖĪĀ¶Č²»±ä£¬ŅĘ¶Æ»īČūP£¬Ź¹ŅŅµÄČŻ»żŗĶ¼×ĻąµČ£¬ŌņŅŅČŻĘ÷ÄŚµÄŃ¹ĒæŌö“ó£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£»
D£®¼×ĪĀ¶ČŗĶĢå»ż²»±ä£¬¼ÓČėŗ¤Ęųŗó¶ŌĘ½ŗāŅʶÆƻӊӰĻģ£¬±£³ÖĪĀ¶ČŗĶŅŅÖŠµÄŃ¹Ēæ²»±ä£¬¼ÓČėŗ¤ĘųŗóŅŅĢå»żŌö“ó£¬Ę½ŗāÓ¦ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ÕżÄę·“Ó¦ĖŁĀŹ¶¼¼õŠ”£®
½ā“š ½ā£ŗæŖŹ¼¼ÓČė4molCŗĶ2molDĻąµ±ÓŚĘšŹ¼¼ÓČė2molAŗĶ4molB£¬¼“ŅŅČŻĘ÷ÄŚµÄĘųĢåµÄĪļÖŹµÄĮæĪŖ¼×ČŻĘ÷ÄŚµÄĘųĢåµÄĪļÖŹµÄĮæµÄ2±¶£¬¶ųŅŅČŻĘ÷µÄĢå»żĪŖ¼×ČŻĘ÷µÄĢå»żµÄ2±¶£¬ŌŚĻąĶ¬ĪĀ¶ČĻĀ“ļµ½ĻąĶ¬Ę½ŗāדĢ¬£¬Ę½ŗāŹ±Ķ¬ÖÖĪļÖŹµÄÅضČĻąµČ£®
A£®±£³ÖĪĀ¶ČŗĶ»īČūĪ»ÖĆ²»±ä£¬ŌŚ¼×ÖŠŌŁ¼ÓČė1molAŗĶ2molB£¬ŌņĻąµ±ÓŚŌŚŌĄ“µÄ»ł“”ÉĻŌö“óŃ¹Ēæ£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬“ļµ½Ę½ŗāŹ±£¬¼×ÖŠCµÄÅØ¶ČŠ”ÓŚŌĄ“µÄ2±¶£¬¼“Š”ÓŚŅŅÖŠCµÄÅØ¶ČµÄ2±¶£¬¹ŹA“ķĪó£»
B£®±£³Ö»īČūĪ»ÖĆ²»±ä£¬ÉżøßĮ½øöČŻĘ÷µÄĪĀ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬¼×”¢ŅŅÖŠBµÄĢå»ż·ÖŹż¶¼¼õŠ”£¬¹ŹB“ķĪó£»
C£®±£³ÖĪĀ¶Č²»±ä£¬ŅĘ¶Æ»īČūP£¬Ź¹ŅŅµÄČŻ»żŗĶ¼×ĻąµČ£¬ŌņŅŅČŻĘ÷ÄŚµÄŃ¹ĒæŌö“ó£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬“ļµ½ŠĀµÄĘ½ŗāŗó£¬ŅŅÖŠCµÄĢå»ż·ÖŹżŠ”ÓŚ¼×ÖŠCµÄĢå»ż·ÖŹżµÄ2±¶£¬¹ŹC“ķĪó£»
D£®¼×ĪĀ¶ČŗĶĢå»ż²»±ä£¬¼ÓČėŗ¤Ęųŗó¶ŌĘ½ŗāŅʶÆƻӊӰĻģ£¬±£³ÖĪĀ¶ČŗĶŅŅÖŠµÄŃ¹Ēæ²»±ä£¬¼ÓČėŗ¤ĘųŗóŅŅĢå»żŌö“ó£¬Ę½ŗāÓ¦ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ÕżÄę·“Ó¦ĖŁĀŹ¶¼¼õŠ”£¬¹ŹDÕżČ·£®
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāŅĘ¶ÆµÄÓ°ĻģŅņĖŲ£¬ĢāÄæÄѶČÖŠµČ£¬×¢Ņā“ӵȊ§Ę½ŗāµÄ½Ē¶Č·ÖĪöĘšŹ¼Ź±¼×ŅŅĮ½ČŻĘ÷ÄŚµÄĘųĢåµÄĘ½ŗāדĢ¬£¬¹Ų¼üŹĒ¶ŌµČŠ§Ę½ŗāµÄĄķ½ā£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øßĆĢĖį¼ŲČÜŅŗÓėŅŅ¶žĖį£Ø²ŻĖį£©·“Ó¦£ŗ2MnO4-+5C2O42-+16H+ØT2Mn2++10CO2”ü+8H2O | |
| B£® | ŌŚNH4HSO4ČÜŅŗÖŠĀżĀżµĪČėµČĪļÖŹµÄĮæµÄNaOHČÜŅŗ£ŗNH4++OH-ØTNH3•H2O | |
| C£® | VO2+ÓėĖįŠŌøßĆĢĖį¼ŲČÜŅŗ·“Ó¦£ŗ5VO2++MnO4-+H2OØT5VO2++Mn2++2H+ | |
| D£® | AgNO3ČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£ŗAg++NH3•H2OØTAgOH”ż+NH4+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
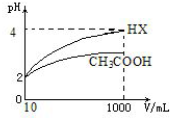
| ČõĖį»ÆѧŹ½ | CH3COOH | HCLO | H2CO3 |
| µēĄėĘ½ŗā³£Źż£Ø25”ę£© | 1.75”Į10-5 | 3.0”Į10-8 | K1=4.4”Į10-7 K2=4.7”Į10-11 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ×°ÖĆÓĆÓŚ¼ģŃéĻūČ„²śĪļ | B£® | 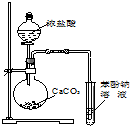 ×°ÖĆ¼ģŃéĖįŠŌ£ŗŃĪĖį£¾Ģ¼Ėį£¾±½·Ó | ||
| C£® | 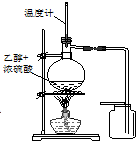 ×°ÖĆÓĆÓŚŹµŃéŹŅÖĘČ”²¢ŹÕ¼ÆŅŅĻ© | D£® | 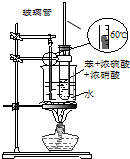 ×°ÖĆÓĆÓŚŹµŃéŹŅÖĘĻõ»ł±½ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
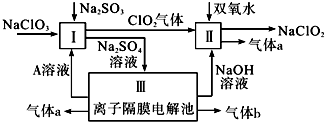
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
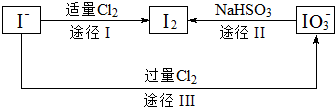
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
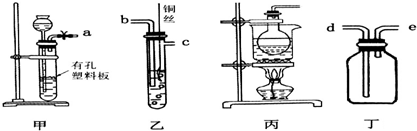
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com