
分析 (1)粗盐中可能含有的杂质是CaCl2和MgCl2,取样品并溶解,加入足量NaOH溶液,可与MgCl2反应生成白色沉淀,再加入数滴Na2CO3溶液与CaCl2反应生成白色沉淀;
(2)溶液需要玻璃棒搅拌,过滤需要玻璃棒引流;
(3)步骤③中加碳酸钠可除去杂质氯化钙,过量的碳酸钠可加盐酸除去;
(4)步骤⑤中发生盐酸与碳酸钠的反应生成NaCl,导致NaCl的质量比原粗盐中NaCl质量大.
解答 解:(1)取样品并溶解,加入足量NaOH溶液,目的是检验有没有Mg2+,接着再加入数滴Na2CO3溶液,目的是检验有没有Ca2+,
故答案为:MgCl2;CaCl2;
(2)溶解、过滤、蒸发等操作过程中都要用到玻璃棒,溶解时用玻璃棒搅拌起到加速溶解的作用;过滤时用玻璃棒引流;蒸发时用玻璃棒搅拌使液体受热均匀,防止液体及晶体溅出,
故答案为:玻璃棒;加快溶解;使液体受热均匀,防止液体溅出;
(3)粗盐中含有的杂质是CaCl2,加入过量的Na2CO3溶液后进行过滤,除去CaCO3沉淀,在滤液中加入适量的稀盐酸,除去多余的Na2CO3,即得到NaCl溶液,蒸发得到纯净的NaCl固体,
故答案为:Na2CO3溶液;逐滴加入稀盐酸,直至不再产生气泡为止;除去过量碳酸钠(或提纯食盐);
(4)由于在步骤③中加入过量的Na2CO3溶液,多余的Na2CO3又与稀盐酸反应生成NaCl,所以固体B中含有的NaCl比原来含有的NaCl多,应测定A的质量,
故答案为:A;蒸发所得到的氯化钠中,有一部分是过量的碳酸钠与稀盐酸反应得到的.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离提纯、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物性质的应用,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列反应中,属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+H2O+CO2↑
B.CaO+H2O=Ca(OH)2
C.CaCO3=CaO+CO2↑
D.2H2O2=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
一 定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
①CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ·mol-1;下列选项正确的是
A.CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ
B.CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(l) ΔH3>ΔH1
C.若用0.2mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
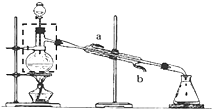 某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:
某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
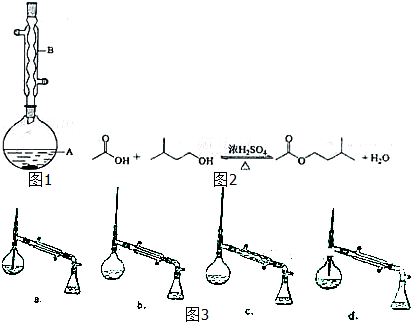
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.
Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
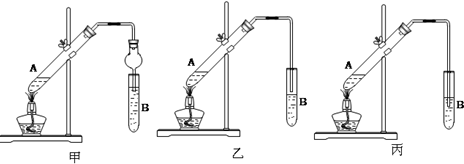
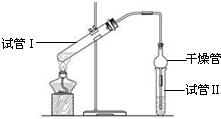 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com