
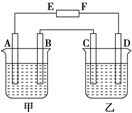
 在如图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol?L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
在如图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol?L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则| 0.01mol |
| 0.1L |
| ||


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
| A、某物质的名称为3,3-二甲基丁烷 |
| B、CH3-CH=CH-C≡C-CF3分子结构中6个碳原子可能在一条直线上 |
| C、某物质的名称为2-乙基-1-丁烯 |
| D、1mol甲基(-CH3)中所含电子数为9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅的分子式:SiO2 | ||
B、2-乙基丁烷: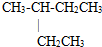 | ||
C、次氯酸的电子式: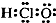 | ||
D、质子数为53,中子数为78的碘原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,它们的物质的量必相等 |
| B、任何条件下,等质量的一氧化二氮(N2O)和二氧化碳所含的分子数必相等 |
| C、1L一氧化碳所体一定比1L氧气质量小 |
| D、等体积、等物质的量浓度的盐酸和醋酸(CH3COOH)中所含的H+数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积:④<①<②<③ |
| B、密度:①<④<③<② |
| C、质量:④<①<③<② |
| D、氢原子数:②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com