
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 光照甲烷和氯气的混合气体后,瓶壁上有油状液滴附着 | |
| C. | 苯滴加到溴水中,震荡后水层接近无色 | |
| D. | 在葡萄糖溶液中加入新制的氢氧化铜,加热后产生砖红色沉淀 |
分析 A.乙烯含碳碳双键,与溴发生加成反应;
B.光照甲烷和氯气时,甲烷中H被Cl取代反应;
C.苯与溴水发生萃取;
D.葡萄糖含-CHO,能被氢氧化铜氧化.
解答 解:A.乙烯含碳碳双键,与溴发生加成反应,则溶液褪色,发生加成反应,故A不选;
B.光照甲烷和氯气时,甲烷中H被Cl取代反应,发生取代反应,故B选;
C.苯与溴水发生萃取,为物理变化,故C不选;
D.葡萄糖含-CHO,能被氢氧化铜氧化,生成砖红色沉淀,为氧化反应,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
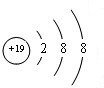
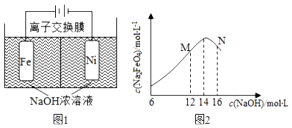
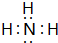 ;⑨的最高价氧化物对应的水化物
;⑨的最高价氧化物对应的水化物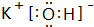 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
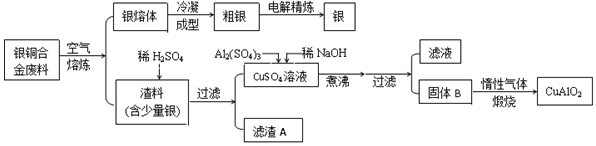
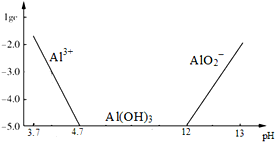
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
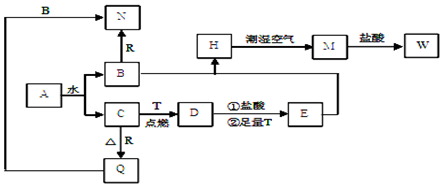

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 | |
| C. | 醋酸钠溶液呈一定的碱性 | |
| D. | 0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷是硅酸盐产品 | B. | 葡萄糖可用于制镜业 | ||
| C. | 纸的主要成分为纤维素 | D. | 汉白玉的主要成分碳酸钙属于碱类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
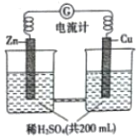 如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )
如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )| A. | 0.75% | B. | 2.94% | C. | 5.88% | D. | 11.76% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com