
����Ŀ��A��B��C��D��E���Ƕ�����Ԫ�أ�ԭ��������������A��B����ͬһ���ڣ�C��D��Eͬ����һ���ڣ�C��B�ɰ�ԭ�Ӹ�����2��1��1��1�ֱ��γ��������ӻ�������ң�Aԭ�ӵ������������ȴ�����������3����E�ǵؿ��к�����ߵĽ���Ԫ�أ�����������Ϣ�ش��������⣺
��1��DԪ�������ڱ��е�λ���� �� ������Ϊ14��Eԭ�ӿɱ�ʾΪ ��
��2��д����A��C�γɵĻ�����Ļ�ѧʽ �� �û����������γɣ�
��3��A��B��C��D��E����Ԫ�ص����Ӱ뾶��С�����˳�����������ӷ�����д����
��4��д��ʵ������ȡA����̬�⻯��Ļ�ѧ����ʽ�� ��
��5�������Ƚ�D��E������ǿ����ʵ�鷽���� ��
���𰸡�
��1���������ڵڢ�A�壻27Al
��2��Na3N������
��3��Al3+��Mg2+��Na+��O2����N3��
��4��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O
CaCl2+2NH3��+2H2O
��5��þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ
���������⣺A��B��C��D��E���Ƕ�����Ԫ�أ�ԭ��������������Aԭ�ӵ������������ȴ������Ӳ��3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ5����AΪNԪ�أ�E�ǵؿ��к�����ߵĽ���Ԫ�أ���EΪAl��A��B����ͬһ���ڣ�C��D��Eͬ����һ���ڣ���CΪNa��DΪMg��C��B�ɰ�ԭ�Ӹ�����2��1��1��1�ֱ��γ��������ӻ�������ң���BΪO����ΪNa2O����ΪNa2O2 ��
��1.��DΪMgԪ�أ������ڱ��е�λ���ǣ��������ڵڢ�A�壬������Ϊ14��Alԭ�ӿɱ�ʾΪ27Al�����Դ��ǣ��������ڵڢ�A�壻27Al��
��2.����A��C�γɵĻ�����Ļ�ѧʽNa3N���������ӻ�����ɺ������Ӽ������Դ��ǣ�Na3N�����ӣ�
��3.�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ�����Ӱ뾶��Al3+��Mg2+��Na+��O2����N3�� �� ���Դ��ǣ�Al3+��Mg2+��Na+��O2����N3����
��4.��A����̬�⻯��Ϊ������ʵ�����Ʊ������Ļ�ѧ����ʽΪ��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O�����Դ��ǣ�2NH4Cl+Ca��OH��2
CaCl2+2NH3��+2H2O�����Դ��ǣ�2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
��5.�����ݽ�������ˮ�ķ�Ӧ��ȷ�������Ļ����ԣ������ʵ��Ϊ��þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ��
���Դ��ǣ�þ����ˮ���Է�Ӧ����������þ����������������ˮ����Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء������й�˵��������ǣ�������
A.������ѧ���ʲ����ã�������ʳƷ������
B.ʯӢ�����õİ뵼����ϣ������Ƴɹ��أ�������ֱ��ת���ɵ���
C.����һ��Ӧ��ش�ţ��Ա��⵰���ʱ���
D.��ͥװ��ʱ��ˮ���������ͳ�������ᣬ�����ڽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����ͬ�ֹ�����Ƭ�ֱ�Ͷ�����������У����������ķ�Ӧ���������ǣ�������
A. 0.1mol/L����15mL B. 0.15mol/L����8mL
C. 0.2mol/L����12mL D. 18mol/L����15mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
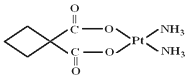
����Ŀ����.����Pt�����ʾ�����ԭ�ӵĶѻ���ʽ����ͼ����ʾ���侧����������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ����ͼ����ʾ��

��1����ͼ��֪���������岬�Ķѻ���ʽΪ_________��һ�������к���___����ԭ�ӣ�����ÿ����ԭ������ҵȾ���IJ�ԭ����_______����
��.��Ԫ�ص�һ�ֻ����PtCl2(NH3)2�����γ����ֹ��壬һ��Ϊ����ɫ����ˮ�е��ܽ�Ƚ�С����һ��Ϊ����ɫ����ˮ�е��ܽ�Ƚϴ���ش��������⣺
��2��PtCl2(NH3)2����ṹ��______________��
��3������ɫ������������___________���(�������Է����������Ǽ��Է�����)��
��4�����ֹ�����ˮ�е��ܽ��Բ��죬������____________ԭ�������ͣ�
��.̼����1��1-��������������ϲ�(��)�ļ�ƣ��ǵڶ������忹��ҩ����̼���ĽṹΪ��
��5����ѧ������ܶ࣬�磺�����Թ��ۼ������Ǽ��Թ��ۼ�������λ���������Ӽ��������������ަ������ߦ�����̼���к��е���������____������ĸ����
A���٢ڢۢޢ� B���٢ڢܢ� C���٢ۢݢ� D���ܢ�
��6����̼�������У�Cԭ�ӵ��ӻ���ʽ��_____ �֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ������ĺ���������XΪ��Ҫԭ�������ɽ�������PCL{![]() }����ȼ������˫��A���ϳ���·���£�
}����ȼ������˫��A���ϳ���·���£�
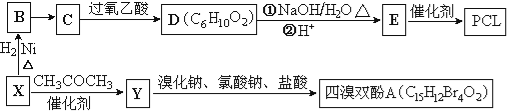
��֪����X�������ܶ�����ͬ������H2��47������FeCl3��Һ����ɫ��CΪ![]()
��![]()
��RCOCH2R��![]() RCOOCH2R��
RCOOCH2R��
��1��X�ķ���ʽΪ_____________ ��B��������_____________��
��2��B��C����Ҫ�ķ�Ӧ�Լ���������_____________ ��C��D�ķ�Ӧ������_____________��
��3��д��X��Y�Ļ�ѧ����ʽ��_____________��
��4��0.5mol����˫��A��һ����������������NaOH��Һ��Ӧ���������_____________ molNaOH��
��5����������������D��ͬ���칹����_____________�֣������ǿռ��칹����
�����������������ֹ����� ����ʹ���CCl4��Һ��ɫ ���ܷ���������Ӧ
��6����֪��ϩ��ֱ���Ʊ������������·���Ϊ��
![]()
������ϩΪ�л�ԭ�ϣ�����ͷ�Ӧ������ѡ���ϳɾۺ���Ϳ��![]() ��д���ϳɸ�Ϳ�ϵķ�Ӧ����ͼ��
��д���ϳɸ�Ϳ�ϵķ�Ӧ����ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaNO2����ۿ���ʳ��������ζ����һ�ֳ��õķ�ɫ���ͷ���������ʹ�ù�����ʹ���ж���ijѧϰС����������������������ʵ�飺
��ʵ��������ȡNaNO2
��С���Ȳ�������֪����2NO+Na2O2 ��2NaNO2��2NO2+Na2O2 ��2NaNO3����NO�ܱ����Ը����������ΪNO3����Ȼ�������ȡװ������ͼ���г�װ����ȥ����
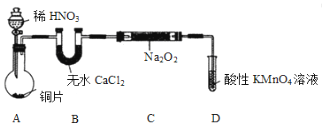
��1��װ��A������ʢ��ϡHNO3��Һ����������Ϊ________��д��װ��A�з�����Ҫ��Ӧ�����ӷ���ʽ��__________��
��2��װ��D��������____________��
��3�����û��Bװ�ã�C�з����ĸ���Ӧ�Ļ�ѧ����ʽ��_______ ����______��
��4����ͬѧ�����װ�����������ú����ʵ�飬�����Ƶõ�NaNO2�л��н϶��NaNO3���ʡ��������ַ����������NaNO2����________��
A.��B�е�ҩƷ��Ϊ��ʯ�� B.��ϡ���ỻΪŨ����
C.ʵ�鿪ʼǰͨһ��ʱ��CO2 D.��A��B֮������ʢ��ˮ��ϴ��ƿ
��ʵ�������ⶨNaNO2��Ʒ��NaNO3�ĺ���
���裺��1������KMnO4����Һ���ữ���ữKMnO4����Ӧѡ��________���ѧʽ��
��2����֪��������Һ�У�NO2-�ɽ�MnO4-��ԭΪMn2+��Ϊ�ⶨ�������Ƶĺ�������ȡ4.000 g��Ʒ����ˮ���250 mL��Һ��ȡ25.00 mL��Һ����ƿ�У���0.1000 mol��L-1����KMnO4��Һ���еζ�������KMnO4 20.00mL������KMnO4��������______��_______���������ù������������Ƶ���������__________�����������һλС����
����չʵ��������ѧϰС��Ϊ���˽�����Ԫ�ص�һЩ���ͻ���������ʣ�����������ʵ��̽����
����֪:����ͭ���ȷֽ���������ͭ������,�����¶Ȳ�ͬ,������ɷ�Ҳ��ͬ������ɷ� ������SO2��SO3��O2�е�һ�֡����ֻ����֡�����ͨ�����һ̽����ʵ�飬�ⶨ��Ӧ������SO2��SO3��O2�����ʵ�������������ȷ�������ʵĻ�ѧ���������Ӷ�ȷ��CuSO4�ֽ�Ļ�ѧ����ʽ��ʵ���õ���������ͼ��ʾ:
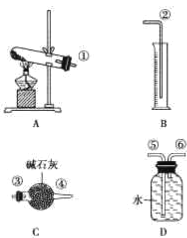
��1���������
����������ijɷֿ���ֻ��________һ��;
����������ijɷֿ��ܺ���________����;
����������ijɷֿ��ܺ���SO2��SO3��O2���֡�
��2��ʵ��̽��
ʵ���������(��)����֪ʵ�����ʱ������ͭ��ȫ�ֽ⡣
��ش�����������
��������װ̽��ʵ���װ�ã����������ҵķ����������ӿڵ�����˳��Ϊ______ (�����)��
�����ڼ���ʱ���¶Ȳ�ͬ��ʵ����������������Ҳ��ͬ������������
ʵ�� | ��ȡCuSO4������/g | ����C ���ӵ�����/g | ��Ͳ��ˮ���������ɱ�״������������/mL |
��һ�� | 6.4 | 2.88 | 224 |
�ڶ��� | 6.4 | 2.56 | 448 |
��ͨ�����㣬�ƶϳ���һ��͵ڶ����ʵ��������CuSO4�ֽⷴӦ�Ļ�ѧ����ʽ��
��һ��_________________�� �ڶ���_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ŷţ������γ�������ǣ� ��
A. ������̼ B. �������� C. �������� D. �Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ,����ƿ�ڳ���ij�������,���ڹ�����,���ι��ڵ�ˮ���뼯��ƿ��,�ձ��е�ˮ����뼯��ƿ,����ƿ��������(����)

��CO��O2 ��Cl2��CH4 ��NO2��O2 ��N2��H2
A. �٢� B. �ڢ� C. �ۢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ���������������Ԫ�أ�ֻ��E�����ڶ����ڣ������Ϣ���±���
Ԫ�� | A | B | C | D | E |
��� | AԪ��ԭ�Ӻ�����3�����Ӳ㣬�������3�����ӣ� | ��Ԫ��C���γ����Ӹ����� | CԪ�ص�ԭ��K��L�������֮�ͱ�L��M�������֮�Ͷ�1������ | DԪ�ؿ��γ��������������һ�����γ��������Ҫ�ɷ� | �䵥������;��㷺�Ľ����� |
�ش��������⣨��ѧ�����е�Ԫ������Ӧ��Ԫ�ط��ű�ʾ����
��1��E��Ԫ�����ڱ��е�λ���� ��
��2��B��DԪ�ض�Ӧ����Է���������С���⻯�����ȷֽ������¶������⻯��Ļ�ѧʽ����
��3��д��B��C�γɻ�����ĵ���ʽ���� ��
��4������D�������������һ���Լ���������E3+�ķ����� ��
��5��д��A��C������������ˮ���ﷴӦ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com