
下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3.
|
| A. | 仅①④ | B. | 仅②④ | C. | 仅①② | D. | 全部 |
考点:
盐类水解的应用.
专题:
盐类的水解专题.
分析:
①FeCl3加热促进水解生成Fe(OH)3和HCl,Fe(OH)3易分解,HCl易挥发;
②Fe2(SO4)3加热水解生成Fe(OH)3和硫酸,但硫酸难挥发,最后又能得到Fe2(SO4)3;
③Ca(HCO3)加热易分解;
④Na2CO3加热促进水解,碳酸钠水解生成碳酸氢钠和氢氧化钠,都是难挥发物质,实质蒸发水.
解答:
解:①FeCl3加热促进水解生成Fe(OH)3和HCl,Fe(OH)3易分解生成Fe2O3,HCl易挥发,最后得到Fe2O3固体,故①错误;
②Al2(SO4)3加热水解生成Al(OH)3和硫酸,但硫酸难挥发,最后又能得到Al2(SO4)3,故②正确;
③Ca(HCO3)加热易分解生成CaCO3,最后得到CaCO3固体,故③错误;
④Na2CO3加热促进水解,碳酸钠水解生成碳酸氢钠和氢氧化钠,都是难挥发物质,实质蒸发水;蒸干得到碳酸钠固体,故④正确.
综上所述:②④符合;
故选B.
点评:
本题考查盐类的水解以及元素化合物知识,题目难度中等,注意硫酸和盐酸的挥发性的不同.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
如图所示,下列关于实验现象的描述正确的是 ( )
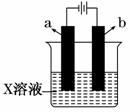
| a电极 | b电极 | X溶液 | 实验现象 | |
| A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
| B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
| C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
| D | 石墨 | 石墨 | HCl | a电极放出无色气体,b电极放出无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol白磷转化为红磷时放出18.39kJ热量,已知:P4(白磷,s)+5O2(g)═2P2O5(s)△H=﹣a kJ/mol(a>0);4P(红磷,s)+5O2(g)═2P2O5(s)△H=﹣b kJ/mol(b>0),则a和b的关系是( )
|
| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时有pH=12的NaOH溶液100mL,要使它的pH为11.(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加0.01mol/L 盐酸,应加 mL;
(4)如果加0.01mol/L 醋酸,所加体积比0.01mol/L 盐酸所用体积 (填“多”、“少”、“一样”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中各微粒的浓度关系不正确的是( )
|
| A. | 0.1 mol/L CH3COOH溶液中:c(CH3COO﹣)+c(CH3COOH)=0.1mol/L |
|
| B. | NaHCO3溶液中:c(OH﹣)=c(H+)+c(H2CO3)﹣c(CO32﹣) |
|
| C. | CH3COONa溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+) |
|
| D. | Na2S溶液中:2 c(Na+)=c(S2﹣)+c(HS﹣)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中的微粒浓度关系正确的是( )
|
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣) |
|
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3) |
|
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+) |
|
| D. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,有关水溶液的pH说法正确的是 ( )。
A.在pH=12的溶液中,水电离出的c(OH-)一定等于10-2 mol·L-1
B.将pH=2和pH=12的酸碱溶液等体积混合后,溶液的pH一定等于7
C.若强酸、强碱中和后pH=7,则中和之前酸、碱的pH之和为14
D.含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液的pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
(1) 实验前用碱液清洗铁钉,再用0.100mol/L的 H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是______。
(2) 为尽量减小误差,下列操作的正确顺序是______(填序号)。
①装入铁钉
②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹
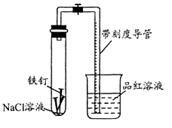 ③将导管口浸入品红溶液
③将导管口浸入品红溶液
④塞上单孔活塞
⑤检查装置气密性
(3) 检查装置气密性的方法:_______________________________。
(4)实验中试管内发生的反应为:____________________________。
用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,
②__________________________________________。
(5) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
假设一:电解质溶液的PH 假设二: NaCl溶液的浓度 假设三:铁钉的表面积
(6)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
①当pH=2时,没有观察到稳定液柱形成的原因是______
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:____________;
第二步: ______,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com