

| A、用装置甲制取氯气 |
| B、用装置乙除去氯气中的少量氯化氢 |
| C、用装置丙分离二氧化锰和氯化锰溶液 |
| D、用装置丁蒸干氯化锰溶液不能制得MnCl2?4H2O |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
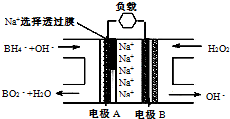 直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是( )
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是( )| A、电极B材料中包含MnO2层,MnO2可起催化作用 |
| B、电池负极区的电极反应为:BH4-+8OH-+8e-=BO2-+6H2O |
| C、放电过程中,Na+ 从正极区向负极区迁移 |
| D、在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
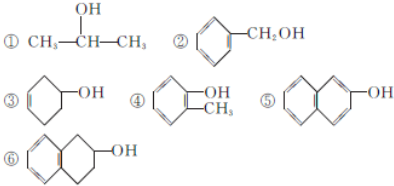
| A、①③④⑤ | B、②③⑥ |
| C、③④⑤⑥ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、异秦皮啶分子式为C11H14O5 |
| B、异秦皮啶与秦皮素均能与NaHCO3溶液反应,放出CO2 |
| C、异秦皮啶与秦皮素可用FeCl3溶液鉴别 |
| D、1mol的秦皮素最多可与4mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将铁锈溶于适量稀硝酸,再滴入KSCN溶液 | 溶液变红 | 该铁锈中只含三价铁 |
| B | 食盐试样中加入盐酸和KI溶液,再加入CCl4振荡 | 下层呈紫红色 | 该食盐试样中可能含有KIO3 |
| C | 某酸雨试样中加入Ba(OH)2溶液 | 有白色沉淀 | 酸雨试样中只含SO42- |
| D | 某卤代烃试样加NaOH溶液煮沸,冷却后用稀硝酸酸化,再加入AgNO3溶液 | 只有白色沉淀 | 该卤代烃为氯代烃 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
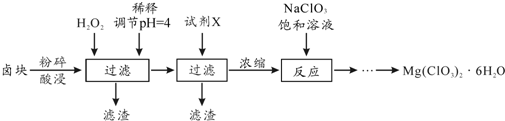
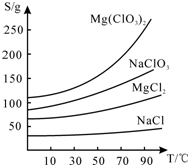
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L CCl4中含有的C-Cl键的个数为2NA |
| B、1 mol Na2O和Na2O2物中含有的阴、阳离子总数是3 NA |
| C、常温下,0.1 mol Cl2通入NaOH溶液中充分反应,转移电子数为0.2 NA |
| D、1 L 0.1 mol?L-1氨水溶液中所含的离子和分子总数大于0.1 NA但小于0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com