
分析 根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算二氧化碳体积、含有分子数、原子数,据此进行解答.
解答 解:3mol二氧化碳在标况下的体积为:22.4L/mol×3mol=67.2L;3mol二氧化碳含有3NA个二氧化碳分子;3mol二氧化碳含有C、O的物质的量为:n(C)=n(CO2)=3mol、n(O)=2n(CO2)=3mol×2=6mol,则3mol二氧化碳分子中含有3NA个C原子,
故答案为:67.2L;3NA;3NA;6.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数之间的关系即可解答,试题有利于培养学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 简单氢化物的稳定性:X>Y>Z | |
| C. | W分别与X、Z形成的化合物均能抑制水的电离 | |
| D. | 在化合物A 的分解反应中丙为氧化产物,丁为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 通KSCN溶液变红色的溶液:NH4+、Al3+、SO42-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
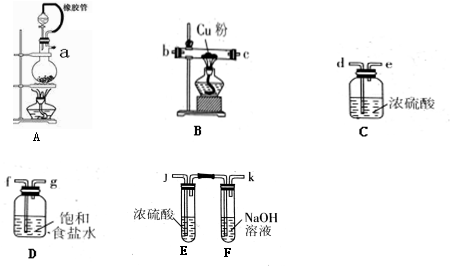
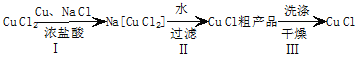
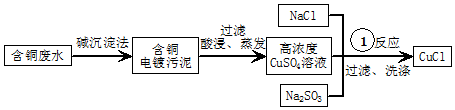
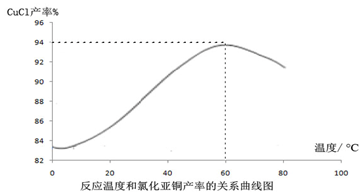
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z |
| A. | Y的单质与水反应时,Y的单质既是氧化剂又是还原剂 | |
| B. | X的最高价氧化物对应的水化物与其气态氢化物可以反应生成盐 | |
| C. | X、Y、Z元素形成的单质,常温下Z单质的沸点最底 | |
| D. | X的氢化物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51 | B. | 54 | C. | 57 | D. | 60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.
.该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
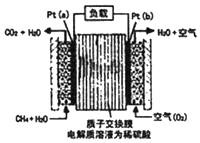 某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为:CH4+2O2═CO2+2H2O.下列有关说法正确的是( )
某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为:CH4+2O2═CO2+2H2O.下列有关说法正确的是( )| A. | 电子由a极流出经过负载流向b极 | |
| B. | 电解质溶液中H+移向a极 | |
| C. | 每转移1mole-,消耗1.6gCH4 | |
| D. | b极上的电极反应式为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com