
| A. | 硝酸和氢氧化钠 | B. | 盐酸和氨水 | C. | 硫酸和氢氧化钾 | D. | 醋酸和氢氧化钡 |
分析 室温下,将pH=3的酸和pH=11的碱等体积混合,若对应的酸碱均为强电解质,则溶液混合后恰好呈中性;
若酸为弱酸而碱为强碱,由于弱电解质部分水解,则弱酸的浓度远远大于10-3mol/L,即弱酸的浓度远远大于碱的浓度,等体积混合时,酸过量,因此溶液显酸性,故D正确;
若酸为酸为强酸而碱为弱碱,由于弱电解质部分水解,则弱碱的浓度远远大于10-3mol/L,即弱碱的浓度远远大于酸的浓度,等体积混合时,碱过量,因此溶液显碱性,据此进行解答.
解答 解:A.室温下,将pH=3的硝酸和pH=11的氢氧化钠等体积混合,若对应的酸碱均为强电解质,则溶液混合后恰好呈中性,溶液的pH=7,故A错误;
B.盐酸为强酸,氨水为弱碱,氨水浓度远远大于10-3mol/L,混合液中氨水过量,溶液的pH大于7,故B错误;
C.硫酸和氢氧化钾都是强电解质,则混合液中强碱恰好反应,溶液为中性,溶液的pH=7,故C错误;
D.醋酸为弱酸,氢氧化钡强碱,则弱酸的浓度远远大于10-3mol/L,即弱酸的浓度远远大于碱的浓度,等体积混合时,酸过量,因此溶液显酸性,混合液的pH小于7,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意弱电解质在溶液中部分电离的特点,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
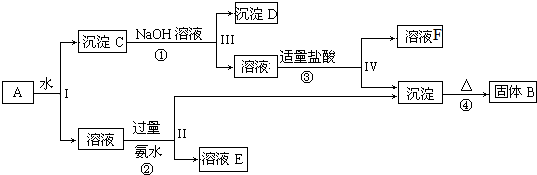
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
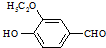 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.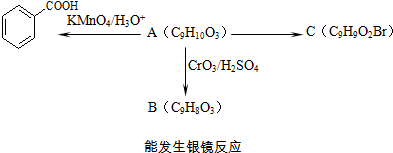
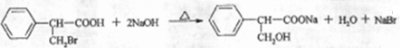
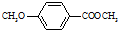 )是一种医药中间体.
)是一种医药中间体. )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com