
����Ŀ����ش�����������
��1�������������ļ��������������з��������ٵ���________________����״���������С����_____________________��
��1gH2 ��2.408��1023��CH4���� ��10.8gH2O ����״����6.72LCO2
��2������ƽ����ʽ��___KClO3+____HCl��Ũ��=___KC1+____ ClO2��+___Cl2��+__H2O��__________
��3����Һ��������ȡ���������ƶ����ӵ�Ũ�Ⱥ����������������Ũ��Խ�����������Խ�࣬��Һ��������Խǿ������Ũ�Ⱦ�Ϊlmol/L�����µ������Һ����K2CO3 ��AgNO3 ��NaHSO4 ��Al2(SO4)3��H2SO4 ��Ba(OH)2����Щ��Һ�е���������ǿ����__________���������������������������____________��
��4����12.4gNa2R��Na+Ϊ0.4mol����Na2R��Ħ������Ϊ____________��
��5����0.2L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ���û����Һ��CuCl2�����ʵ���Ũ��Ϊ____________ molL-1��

��6����ͼ��ʾ�ľ�ʾ��־����һ��____________����ѡ���������

A.��ȼƷ B.�綾Ʒ C.��ʴƷ D.��ըƷ
���𰸡� �� �� 2 KClO3+ 4 HCl��Ũ��= 2 KCl+ 2 ClO2��+ 1 Cl2��+ 2 H2O �� �� 62g/mol 0.5mol��L-1 C
����������1����n��H2��=![]() =0.5mol��V��H2��=0.5mol��22.4L/mol=11.2L����n��CH4��=
=0.5mol��V��H2��=0.5mol��22.4L/mol=11.2L����n��CH4��=![]() =0.4mol��V��CH4��=0.4mol��22.4L/mol=8.96L����n��H2O��=
=0.4mol��V��CH4��=0.4mol��22.4L/mol=8.96L����n��H2O��=![]() =0.6mol�����ԼΪ10.8mL����n��CO2��=
=0.6mol�����ԼΪ10.8mL����n��CO2��=![]() =0.3mol����״�������Ϊ6.72L�����ʵ���Խ�٣�������Խ�٣����ٵ��Ǣܣ���״���������С���Ǣۣ�(2) ������е�+5����ȫ��ת��Ϊ���������е�+4���ȣ� HCl��Cl��-1�۱�Ϊ0�ۣ����ݻ��ϼ����������غ㡢�����غ���ã�2KClO3+4HCl��Ũ��=2 KCl+2ClO2��+1Cl2��+ 2 H2O����3����Һ�������ƶ������ӹ�Ũ��Խ�����������Խ�࣬��ʱ��Խǿ����֮Խ���������Щ��Һ�е���������ǿ��������������ѡ�ܣ�����������������AgNO3����ѡ�ڣ���4����Һ�еĵ���غ㣺c��Na+����1+c��Mg2+����2+c��Cu2+����2=c��Cl������1��1.0 molL��1 +0.5 molL��1��2+c��Cu2+����2=3 molL��1��1��c��Cu2+��=0.5 molL��1��c��CuCl2��=0.5 molL��1����6����ʾ��־
=0.3mol����״�������Ϊ6.72L�����ʵ���Խ�٣�������Խ�٣����ٵ��Ǣܣ���״���������С���Ǣۣ�(2) ������е�+5����ȫ��ת��Ϊ���������е�+4���ȣ� HCl��Cl��-1�۱�Ϊ0�ۣ����ݻ��ϼ����������غ㡢�����غ���ã�2KClO3+4HCl��Ũ��=2 KCl+2ClO2��+1Cl2��+ 2 H2O����3����Һ�������ƶ������ӹ�Ũ��Խ�����������Խ�࣬��ʱ��Խǿ����֮Խ���������Щ��Һ�е���������ǿ��������������ѡ�ܣ�����������������AgNO3����ѡ�ڣ���4����Һ�еĵ���غ㣺c��Na+����1+c��Mg2+����2+c��Cu2+����2=c��Cl������1��1.0 molL��1 +0.5 molL��1��2+c��Cu2+����2=3 molL��1��1��c��Cu2+��=0.5 molL��1��c��CuCl2��=0.5 molL��1����6����ʾ��־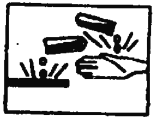 �Ǹ�ʴƷ����ѡC��
�Ǹ�ʴƷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��pH=3������ʹ����1mL�ֱ��ˮϡ�ͣ�pH����Һ����仯����������ͼ��ʾ������˵������ȷ����

A. ����I���������ϡ����
B. a��Һ�ĵ����Ա�b��Һ�ĵ�����ǿ
C. b��Һ�к��������Ƶ�����ǿ��a��Һ
D. ��a��b����Һ������30�棬 ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ����2.0L�����ܱ������г���2mol SO2��1mol O2 �� ������Ӧ�� 2SO2��g��+O2��g��2SO3��g��������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | t1 | t2 | t3 | t4 |
n��SO3��/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
����˵����ȷ���ǣ� ��
A.��Ӧ��ǰt1 s ��ƽ������v��O2��= ![]() ?mol?L��1?s��1
?mol?L��1?s��1
B.���������������䣬���ѹ����1.0L��ƽ�ⳣ��������
C.��ͬ�¶��£���ʼʱ�������г���4mol SO3 �� �ﵽƽ��ʱ��SO3��ת���ʴ���10%
D.�����¶Ȳ��䣬����������ٳ���2mol SO2��1mol O2 �� ��Ӧ�ﵽ��ƽ��ʱ ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��û�ѧ����ش���������:
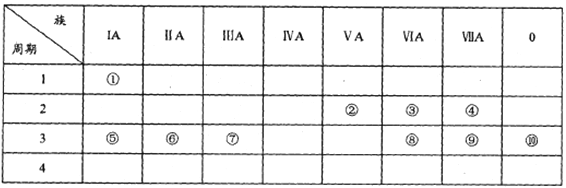
��1���뻭��Ԫ���������ӵĽṹʾ��ͼ:________��
��2���ۢݢ���ԭ�Ӱ뾶��С�����˳��Ϊ________(��Ԫ�ط���)��
��3��������������������Ӧˮ����ļ���ǿ��Ϊ_____>____(�ѧʽ)��
��4���ۢ�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ĵ���ʽΪ_______��
��5���õ���ʽ��ʾ�������γɵĻ�����Ĺ���:_________��
II.�ɱ�����~���е�һ�ֻ���Ԫ���γɵij�������A��B��C�ɷ������·�Ӧ(����������ȥ)����ش���������:
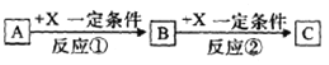
��1����X��һ�ֳ������ɽ������ʣ���C��ˮ��Һ�еμ�AgNO3��Һ������������ϡ����İ�ɫ�����������C��Һ�н������ӵķ�����_______����֪��������Һ�иý��������ܱ�˫��ˮ������д���÷�Ӧ�����ӷ���ʽ:___________��
��2����A��B��CΪ����ͬһ����Ԫ�ص��������XΪǿ�A��Һ��C��Һ��Ӧ����B����B�Ļ�ѧʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Na2SO3����������ɷ�����Ӧ��Na2SO3+ H2SO4=Na2SO4+H2O+SO2������ͼ��ʵ������ȡSO2����֤SO2��ijЩ���ʵ�װ��ͼ���ش���ȷ������ ��

A. ���е�ʵ������Ϊ��ɫʯ����Һ��ɫ��ʵ��֤��SO2����Ư����
B. ������Һ���������ΪSO2��H2S������������ԭ��Ӧ����������ͻ�ԭ����������Ϊ1��1
C. ����������Һ����ɫ������ɫ��ԭ����ͬ
D. ʵ�����п����ó���ʯ��ˮ��������������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������Һ�д����������( )
A. Ag����K����NO3-��Cl�� B. Mg2����Na����Cl����SO42-
C. Ca2����Mg2����OH����Cl�� D. H����Na����CO32-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������;��˵������ȷ���ǣ� ��
A.������������������IJ���
B.�������������������ˮ��
C.̼�����ƿ���������θ�����
D.������̼������þȼ�յ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��W��Ԫ�����ڱ��еĶ�����Ԫ�أ������ʻ�ṹ��Ϣ���±���
Ԫ�� | X | Y | Z | V | W |
������Ϣ | ����Ϊ��ɫ���壬�ж�������������ˮ���� | �ճ������г����������ۻ�ʱ�������䣬������һ��Ĥ���� | �䵥���ڿ�����Լռ4/5���� | ����Ϊ����ɫ���壬�ʴ࣬������ˮ�����ھƾ� | λ�ڵڢ�A�����γɵĻ���������Ԫ��֮һ |
�ش��������⣺
(1)X��Ԫ�����ڱ��е�λ����____________��V2�����ӽṹʾ��ͼΪ______________��
(2)Z�ĵ����ر��ȶ���ԭ������_______________��X��Y��V��Ԫ����ԭ�Ӱ뾶��С����_________��
(3)WV2�����³�Һ̬����һ�ֳ������ܼ�����֪WV2����������ȫȼ�գ�����VO2��WO2����0.1 mol WV2��1 mol O2����ȫȼ�գ����������������ڱ�״���µ����Ϊ________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʱ���ڡ����ݸ�Ŀ����д�����վƷǹŷ�Ҳ����Ԫʱʼ���䷨����Ũ�ƾ�������굣��������ϣ�������ȡ��¶���������漰�IJ���������
A.��ҺB.��ȡC.����D.����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com