



科目:高中化学 来源: 题型:

查看答案和解析>>
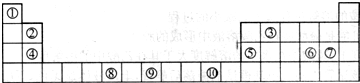
科目:高中化学 来源: 题型:阅读理解
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |
| M | ||
4
|
| M | ||
4
|
查看答案和解析>>
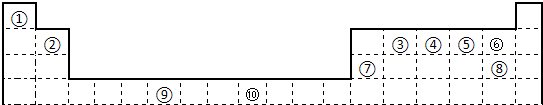
科目:高中化学 来源: 题型:
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素
试填空
(1)写出①、④两元素按原子个数比为1:1形成的化合物的电子式 ;写出上表中元素⑨原子的外围电子排布式 ;
(2)元素②与⑦形成的化合物的晶体类型是:_ _ _;
(3)元素⑤、⑥的第一电离能大小顺序是: > (用元素符号表示);元素③与元素①形成的X分子的空间构型为: 。请写出一种与N3—互为等电子体的分子的化学式
(4)⑦、⑧两种元素能形成一种AB2型的共价分子,该分子属于 分子(填“极性”或“非极性”)⑤、⑦、 ⑾三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素的单质。请写出⑦、⑾两种元素形成的互化物的化学式 (正价元素写在前面)。
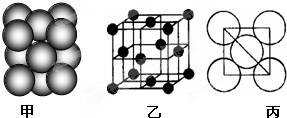
(5)元素⑩在元素周期表分区中属于 区元素,元素⑩在一定条件下形成的晶体的两种晶胞如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。
查看答案和解析>>
科目:高中化学 来源:2009—2010泉州七中学年度下学期高二年期中考试化学卷 题型:填空题
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素
试填空
(1)写出①、④两元素按原子个数比为1:1形成的化合物的电子式 ;写出上表中元素⑨原子的外围电子排布式 ;
(2)元素②与⑦形成的化合物的晶体类型是:_ _ _;
(3)元素⑤、⑥的第一电离能大小顺序是: > (用元素符号表示);元素③与元素①形成的X分子的空间构型为: 。请写出一种与N3—互为等电子体的分子的化学式 
(4)⑦、⑧两种元素能形成一种AB2型的共价分子,该分子属于 分子(填“极性”或“非极性”)⑤、⑦、⑾三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素的单质。请写出⑦、⑾两种元素形成的互化物的化学式 (正价元素写在前面)。
(5)元素⑩在元素周期表分区中属于 区元素,元素⑩在一定条件下形成的晶体的两种晶胞如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。
查看答案和解析>>
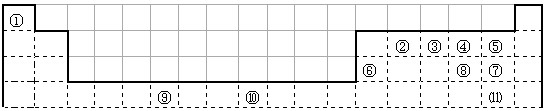
科目:高中化学 来源:2012届江苏省无锡一中高三9月初检测化学试卷 题型:填空题
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。试填空。
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | | | | | | | | | | | | ⑦ | | | | ⑧ | |
| | | | | | ⑨ | | | ⑩ | | | | | | | | | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com