
分析 (1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小;
(4)氯化铁具有强氧化性,可氧化二氧化硫气体;
(5)阳极上亚硫酸根离子在阳极上失去电离生成硫酸根离子.
解答 解:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,
故答案为:Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;2Fe3++Fe=3Fe2+;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol•L-1,则溶液pH=-lg1.0×10-2=2,
故答案为:2;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:1;6;6H+;1;6;3H2O;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3,
故答案为:K1>K2>K3;
(4)氯化铁具有强氧化性,可氧化二氧化硫气体,反应的方程式为2FeCl3+SO2+2H2O═2FeCl2+H2SO4+2HCl,氢氧化钠与二氧化硫发生中和反应,方程式为2NaOH+SO2=Na2SO3+H2O,故答案为:2FeCl3+SO2+2H2O═2FeCl2+H2SO4+2HCl、2NaOH+SO2=Na2SO3+H2O;
(5)亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,电极反应式为:SO32--2e-+H2O=SO42-+2H+;
故答案为:SO32--2e-+H2O=SO42-+2H+.
点评 本题考查铁的化合物性质的应用、氧化还原反应方程式的配平、对图象的分析能力、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.
一定条件下,将1mol N2和1.0mol H2充入容积为10L的恒容密闭容器中合成NH3、N2、H2的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2体积不变 | B. | 剩余三分之一体积一氧化氮气体 | ||
| C. | 溶液充满集气瓶 | D. | 二氧化氮和一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| B. | Zn具有氧化性和导电性,可用作锌锰干电池的负极材料 | |
| C. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
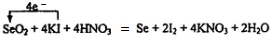 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝便于运输、贮存,从安全角度考虑,铝是最佳燃料之一 | |
| B. | 铝资源比较丰富,易于开采,且可以再生 | |
| C. | 铝燃烧热大,燃烧污染小,易有效控制 | |
| D. | 寻找高效催化剂,使A12O3分解同时释放能量,是铝能源大规模开发利用的一项关键技术 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com