
2NH3![]() N2 + 3H2
N2 + 3H2
B. 1.2 1.2 1.2
C. 1.2 0.8 0.8
D. 0.6 1.2 1.6
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、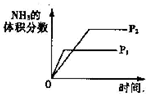 压强对反应的影响 | B、 温度对反应的影响 | C、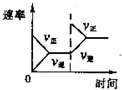 在平衡体系中增加N2对反应的影响 | D、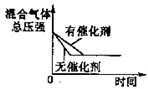 催化剂对反应的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
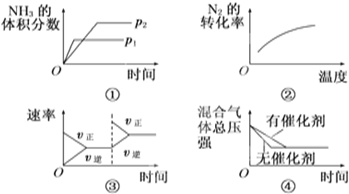
| A、①压强对反应的影响(p2>p1) | B、②温度对反应的影响 | C、③平衡体系增加N2对反应的影响 | D、④催化剂对反应的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com