
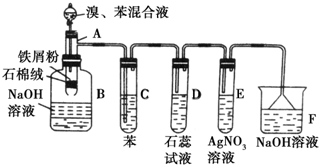
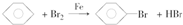 (催化剂也可以写FeBr3).
(催化剂也可以写FeBr3).分析 制取溴苯时,Fe和溴发生反应生成溴化铁,在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯和HBr,溴苯密度较大,B中氢氧化钠能吸收未反应的溴;溴具有挥发性,所以生成的HBr中含有溴,溴极易溶于苯中,所以C的作用是溶解溴,溶液呈橙色;溴化氢溶于水生成氢溴酸,溶液呈酸性,能使石蕊试液变红色;HBr和硝酸银反应生成淡黄色AgBr沉淀,未反应的溴和溴化氢不能排空,应该用氢氧化钠吸收.
(1)在溴化铁作催化剂条件下苯和溴发生取代反应生成溴苯和HBr;
(2)溴极易溶于苯,可以用苯吸收溴;
(3)反应开始后,E中出现淡黄色固体为溴化氢能和硝酸银反应生成的溴化银沉淀;
(4)根据防倒吸的原理,有缓冲作用的装置能防倒吸.
解答 解:(1)在溴化铁作催化剂条件下苯和溴发生取代反应,苯环上一个氢原子被溴原子取代,生成溴苯和HBr,反应方程式为: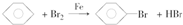 (催化剂也可以写FeBr3),
(催化剂也可以写FeBr3),
故答案为: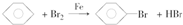 (催化剂也可以写FeBr3);
(催化剂也可以写FeBr3);
(2)溴具有挥发性,所以生成的HBr中含有溴,溴极易溶于苯中,所以C的作用是溶解溴,吸收HBr气体中的Br2蒸气,
故答案为:吸收HBr气体中的Br2蒸气;
(3)溴化氢能和硝酸银反应生成淡黄色沉淀,所以看到E中出现淡黄色沉淀,反应为:Ag++Br-=AgBr↓,
故答案为:Ag++Br-=AgBr↓;
(4)装置D和E导管口在液面上方,能防止倒吸,倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,
故答案为:DEF.
点评 本题以溴苯为载体考查物质制备,为高频考点,明确实验原理及物质性质、实验操作等知识点即可解答,知道各个装置的作用及发生的反应,知道物质检验方法,题目难度中等.


 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
 氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的实验装置如图所示:
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑥ | C. | ④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气除去乙烯 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,先加入稀硫酸酸化,再滴加硝酸银溶液 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 实验室制取乙炔时,常用饱和食盐水代替水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com