

分析 由元素在周期表中位置可知,a为H、b为Na、c为Mg、d为C、e为N、f为P、g为Cl.
(1)电负性相差最大,最容易形成离子键,电负性相差最小最易形成共价键;
(2)化合价绝对值+原子最外层电子数=8,满足8电子稳定结构,含有H元素一定不满足8电子结构.
解答 解:由元素在周期表中位置可知,a为H、b为Na、c为Mg、d为C、e为N、f为P、g为Cl.
(1)同周期自左而右电负性增大、同主族自上而下电负性减小,选项中元素中电负性相差最大为Na与Cl,最容易形成离子键,电负性相差最小为C、Cl,最易形成共价键,故答案为:B;C;
(2)各选项对应的分子分别为NH3、HCl、PCl3、CCl4,其中NH3、HCl中由于氢形成的是2电子稳定结构,故不符合题意.而PCl3、CCl4中各元素化合价绝对值与原子最外层电子数之和均为8,均满足8电子稳定结构,故选:CD.
点评 本题考查元素周期表与化学键等,侧重考查学生分析能力,注意对元素周期律的理解掌握,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 | |
| B. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组利用如下装置合成化工原料正丁醛.发生的反应如下:
某实验小组利用如下装置合成化工原料正丁醛.发生的反应如下:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | NaCl固体 | C. | NaOH溶液 | D. | CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
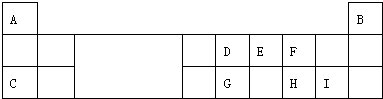
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,
 .E可以进行喷泉实验的主要原因是:因为NH3极易溶于水.
.E可以进行喷泉实验的主要原因是:因为NH3极易溶于水. NH3.H2O+H+
NH3.H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
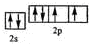 ,该元素的名称是氧.
,该元素的名称是氧.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热到100℃时,水的pH=6 | B. | 向水中滴加少量稀H2SO4 | ||
| C. | 向水中加入少量NaHCO3 | D. | 向水中加入少量胆矾晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com