
ЁОЬтФПЁПдкФГЮТЖШЃЈTЁцЃЉЕФЫЎШмвКжаЃЌc(H+)ЃН10xmol/LЃЌc(OHЃ)ЃН10ymol/LЃЌxгыyЙиЯЕШчЭМЫљЪОЁЃ
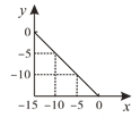
ЃЈ1ЃЉИУЮТЖШЯТЃЌЫЎЕФРызгЛ§ЮЊ________ЃЌTЁц_____25ЁцЃЈЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБЃЉЁЃ
ЃЈ2ЃЉНЋДЫЮТЖШЯТpHЃН11ЕФNaOHШмвКгыpHЃН1ЕФHClШмвКЕШЬхЛ§ЛьКЯЃЌЛьКЯКѓШмвКЕФpHдМЮЊ________ЁЃЃЈвбжЊlg2ЃН0.3ЃЉ
ЃЈ3ЃЉдкДЫЮТЖШЯТЃЌНЋpHЃН13ЕФNaOHШмвКVaLгыpHЃН1ЕФСђЫсШмвКVbLЛьКЯЁЃШєЫљЕУЛьКЯвКЕФpHЃН2ЃЌдђVa:Vb ЃН_______ЁЃ
ЁОД№АИЁП10-15 аЁгк 1.3 9:2
ЁОНтЮіЁП
ЂХИљОнЯпЩЯЬиЪтЕуЧѓГіx КЭyЕУГіЫЎЕФРызгЛ§ЁЃ
ЂЦЧѓГіДЫЮТЖШЯТpHЃН11ЕФNaOHШмвКc(OHЃ)КЭpHЃН1ЕФHClШмвКc(H+)ЃЌдйМЦЫуЛьКЯКѓШмвКЕФЧтРызгХЈЖШКЭpHЁЃ
ЂЧСаГідкДЫЮТЖШЯТЃЌНЋpHЃН13ЕФNaOHШмвКVa LЕФc(OHЃ)КЭpHЃН1ЕФСђЫсШмвКVb LЕФc(H+)ЃЌИљОнЬтвтНЈСЂЙиЯЕЪНЕУЕНVaЃКVbЁЃ
ЂХбАевЯпЩЯвЛЕуЕУЕНx ЃН5ЪБЃЌyЃН 10ЃЌвђДЫИУЮТЖШЯТЃЌЫЎЕФРызгЛ§ЮЊ![]() ЃЌ
ЃЌ![]() ЃЌЮТЖШдНЕЭЃЌРызгЛ§ГЃЪ§дНаЁЃЌвђДЫT ЁцаЁгк25 ЁцЃЛЙЪД№АИЮЊЃК1015ЃЛаЁгкЁЃ
ЃЌЮТЖШдНЕЭЃЌРызгЛ§ГЃЪ§дНаЁЃЌвђДЫT ЁцаЁгк25 ЁцЃЛЙЪД№АИЮЊЃК1015ЃЛаЁгкЁЃ
ЂЦДЫЮТЖШЯТpHЃН11ЕФNaOHШмвКc(OHЃ)ЃН1ЁС104molL1ЃЌpHЃН1ЕФHClШмвКc(H+)ЃН1ЁС101molL1ЃЌНЋСНепЕШЬхЛ§ЛьКЯЃЌ![]() ЃЌЛьКЯКѓШмвКЕФpHдМЮЊpHЃН2lg5 ЃН20.7ЃН1.3ЃЌЙЪД№АИЮЊЃК1.3ЁЃ
ЃЌЛьКЯКѓШмвКЕФpHдМЮЊpHЃН2lg5 ЃН20.7ЃН1.3ЃЌЙЪД№АИЮЊЃК1.3ЁЃ
ЂЧдкДЫЮТЖШЯТЃЌpHЃН13ЕФNaOHШмвКVa LЃЌc(OHЃ)ЃН1ЁС102molL1ЃЌpHЃН1ЕФСђЫсШмвКVb LЃЌc(H+)ЃН1ЁС101molL1ЃЌНЋСНепЛьКЯЫљЕУЛьКЯвКЕФpHЃН2ЃЌ![]() ЃЌдђVaЃКVb ЃН9:2ЃЛЙЪД№АИЮЊЃК9ЃК2ЁЃ
ЃЌдђVaЃКVb ЃН9:2ЃЛЙЪД№АИЮЊЃК9ЃК2ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБЅКЭЖўбѕЛЏСђЫЎШмвКжаДцдкЯТСаЦНКтЬхЯЕЃКSO2+H2O![]() H++HSO3Љ HSO3Љ
H++HSO3Љ HSO3Љ![]() H++SO32ЉЃЌШєЯђДЫШмвКжаЃЈЁЁЁЁЃЉ
H++SO32ЉЃЌШєЯђДЫШмвКжаЃЈЁЁЁЁЃЉ
A.МгЫЎЃЌSO32ЉХЈЖШдіДѓ
B.ЭЈШыЩйСПCl2ЦјЬхЃЌШмвКpHдіДѓ
C.МгЩйСПCaSO3ЗлФЉЃЌHSO3ЉХЈЖШЛљБОВЛБф
D.ЭЈШыЩйСПHClЦјЬхЃЌШмвКжаHSO3ЉХЈЖШМѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃК![]() ЃЈXЮЊТБЫидзгЃЉЃЛ
ЃЈXЮЊТБЫидзгЃЉЃЛ
Ђђ.гы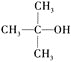 НсЙЙЯрЫЦЕФДМВЛФмБЛбѕЛЏГЩШЉЛђЫсЁЃ
НсЙЙЯрЫЦЕФДМВЛФмБЛбѕЛЏГЩШЉЛђЫсЁЃ
ЁАжЧФмаЭЁБДѓЗжзгдкЩњЮяЙЄГЬжагаЙуЗКЕФгІгУЧАОАЃЌ![]() ОЭЪЧвЛжжЁАжЧФмаЭЁБДѓЗжзгЃЌПЩгУгкЩњЮяжЦвЉжаДѓЗжзггыаЁЗжзгЕФЗжРыЁЃЯТЭМЪЧвдЬў
ОЭЪЧвЛжжЁАжЧФмаЭЁБДѓЗжзгЃЌПЩгУгкЩњЮяжЦвЉжаДѓЗжзггыаЁЗжзгЕФЗжРыЁЃЯТЭМЪЧвдЬў![]() ЮЊЦ№ЪМЗДгІЮяКЯГЩ
ЮЊЦ№ЪМЗДгІЮяКЯГЩ![]() ЕФТЗЯпЭМЃК
ЕФТЗЯпЭМЃК

ИљОнЩЯЪіЙ§ГЬЛиД№ЯТСаЮЪЬтЃК
(1)аДГіЖдгІЮяжЪЕФНсЙЙМђЪНЃК![]() _______________ЃЌ
_______________ЃЌ![]() _______________ЁЃ
_______________ЁЃ
(2)аДГіЩЯЪіЙ§ГЬжаЫљЗЂЩњЗДгІЕФЗДгІРраЭЃКЂй____________ЃЌЂк_____________ЃЌЂл_________ЃЌЂм_________ЁЃ
(3)аДГіЗДгІЂлЕФЛЏбЇЗНГЬЪНЃК_____________________ЁЃ
(4)![]() дкХЈСђЫсДцдкВЂМгШШЕФЬѕМўЯТЗДгІЛЙПЩФмЩњГЩвЛжжСљдЊЛЗзДВњЮяЃЌИУСљдЊЛЗзДВњЮяЕФНсЙЙМђЪНЮЊ_____________________ЁЃ
дкХЈСђЫсДцдкВЂМгШШЕФЬѕМўЯТЗДгІЛЙПЩФмЩњГЩвЛжжСљдЊЛЗзДВњЮяЃЌИУСљдЊЛЗзДВњЮяЕФНсЙЙМђЪНЮЊ_____________________ЁЃ
(5)ЯТСагаЙи![]() ЕФЫЕЗЈе§ШЗЕФЪЧ___________ЃЈЬюађКХЃЉЁЃ
ЕФЫЕЗЈе§ШЗЕФЪЧ___________ЃЈЬюађКХЃЉЁЃ
A.ФмЙЛЗЂЩњМгГЩЗДгІ B.ФмЙЛЗЂЩњѕЅЛЏЗДгІ
C.ВЛФмШМЩе D.ФмЙЛЪЙЫсад![]() ШмвКЭЪЩЋ
ШмвКЭЪЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮТЖШЮЊT0ЪБЃЌX(g)КЭY(g)дк2 LЕФУмБеШнЦїжаЗЂЩњЗДгІЩњГЩZ(g)ЃЌИїЮяжЪЕФЮяжЪЕФСПЫцЪБМфБфЛЏЕФЙиЯЕШчЭМaЫљЪОЁЃЦфЫћЬѕМўЯрЭЌЃЌЮТЖШЗжБ№ЮЊT1ЁЂT2ЪБЗЂЩњЗДгІЃЌXЕФЮяжЪЕФСПЫцЪБМфБфЛЏЕФЙиЯЕШчЭМbЫљЪОЁЃЯТСаа№ЪіжаДэЮѓЕФЪЧ
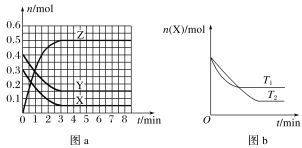
A.ЗДгІЕФЗНГЬЪНЮЊX(g)ЃЋY(g)![]() 2Z(g)
2Z(g)
B.X(g)гыY(g)ЩњГЩZ(g)ЕФЗДгІЪЧЗХШШЗДгІ
C.ЭМaжаЗДгІДяЕНЦНКтЪБЃЌYЕФзЊЛЏТЪЮЊ62.5%
D.T1ЪБЃЌШєИУЗДгІЕФЦНКтГЃЪ§KЕФжЕЮЊ50ЃЌдђT1ЃОT0
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўбѕЛЏЬМгУВЛЭЌДпЛЏМСДпЛЏЩњГЩвЛбѕЛЏЬМЕФРњГЬжаФмСПЕФзЊБфШчЭМЫљЪОЃЌ(ЮќИНдкДпЛЏМСБэУцЕФгУЁАЁЄЁББэЪОЃЉЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
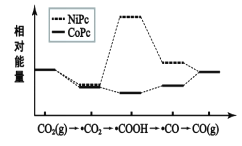
A.ЪЙгУДпЛЏМСNiPcашвЊЕФЬѕМўИќИп
B.ЁЄCOOHОЙ§ЛЙдЗДгІЕУЕНCO
C.ЗДгІЙ§ГЬжаДцдкМЋадМќЕФЖЯСбКЭЩњГЩ
D.ЯрЭЌЮЂСЃЮќИНдкВЛЭЌЕФДпЛЏМСЪБФмСПЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФћУЪЯЉЪЧвЛжжЪГгУЯуСЯЃЌЦфНсЙЙМђЪНШчЭМЫљЪОЁЃЯТСагаЙиФћУЪЯЉЕФЗжЮіе§ШЗЕФЪЧЃЈ ЃЉ
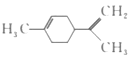
A.ЫќЕФвЛТШДњЮяга6жж
B.ЫќЕФЗжзгжаЫљгаЕФЬМдзгвЛЖЈдкЭЌвЛЦНУцЩЯ
C.ЫќКЭЖЁЛљБНЃЈШчЭМЫљЪОЃЉЛЅЮЊЭЌЗжвьЙЙЬх![]()
D.вЛЖЈЬѕМўЯТЃЌЫќЗжБ№ПЩвдЗЂЩњМгГЩЁЂШЁДњЁЂбѕЛЏЕШЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКњНЗЗгЪЧжВЮяЛгЗЂгЭЕФГЩЗжжЎвЛЃЌЫќЕФНсЙЙЮЊШчЭМЫљЪОЃЌЯТСаа№Ъіжае§ШЗЕФЪЧЃЈ ЃЉ
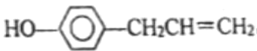
A.1molКњНЗЗгзюЖрПЩгы4mol H2ЗЂЩњМгГЩЗДгІ
B.1molКњНЗЗгзюЖрПЩгы4mol Br2ЗЂЩњМгГЩЗДгІ
C.ИУгаЛњЮяКЫДХЙВеёЧтЦзга8зщЗхЃЌЗхУцЛ§БШЮЊ1ЃК1ЃК2ЃК2ЃК1ЃК2ЃК1ЃК2
D.ИУгаЛњЮяЫљгадзгОљПЩдкЭЌвЛЦНУцЩЯ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзЭщОЇЬхЕФОЇАћНсЙЙШчЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

A.МзЭщОЇАћжаЕФЧђжЛДњБэ1ИіCдзг
B.ОЇЬхжа1ИіCH4ЗжзгжмЮЇга12ИіНєСкЕФCH4Зжзг
C.МзЭщОЇЬхШлЛЏЪБашПЫЗўЙВМлМќ
D.1ИіCH4ОЇАћжаКЌга8ИіCH4Зжзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУЬМКЭЫЎеєЦјжЦБИЫЎУКЦјЕФКЫаФЗДгІЮЊЃКC(s)ЃЋH2O(g)H2(g)ЃЋCO(g)
(1)вбжЊЬМ(ЪЏФЋ)ЁЂH2ЁЂCOЕФШМЩеШШЗжБ№ЮЊ393.5kJЁЄmolЃ1ЁЂ285.8kJЁЄmolЃ1ЁЂ283kJЁЄmolЃ1ЃЌгжжЊH2O(l)=H2O(g)ЁЁІЄHЃНЃЋ44kJЁЄmolЃ1ЃЌдђC(s)ЃЋH2O(g)CO(g)ЃЋH2(g)ЁЁІЄHЃН___ЁЃ
(2)дкФГЮТЖШЯТЃЌдкЬхЛ§ЮЊ1LЕФКуШнУмБеИеадШнЦїжаМгШызуСПЛюадЬПЃЌВЂГфШы1mol H2O(g)ЗЂЩњЩЯЪіЗДгІЃЌЗДгІЪБМфгыШнЦїФкЦјЬхзмбЙЧПЕФЪ§ОнШчБэЃК
ЪБМф/min | 0 | 10 | 20 | 30 | 40 |
змбЙЧП/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
ЂйЦНКтЪБЃЌШнЦїжаЦјЬхзмЮяжЪЕФСПЮЊ________molЃЌH2OЕФзЊЛЏТЪЮЊ________ЁЃ
ЂкИУЮТЖШЯТЗДгІЕФЦНКтЗжбЙГЃЪ§KpЃН________kPa(НсЙћБЃСє2ЮЛгааЇЪ§зж)ЁЃ
(3)БЃГж25ЁцЁЂЬхЛ§КуЖЈЕФ1LШнЦїжаЭЖШызуСПЛюадЬПКЭЯрЙиЦјЬхЃЌЗЂЩњПЩФцЗДгІCЃЋH2O(g)COЃЋH2ВЂвбНЈСЂЦНКтЃЌдк40 minЪБдйГфШывЛЖЈСПH2ЃЌ50minЪБдйДЮДяЕНЦНКтЃЌЗДгІЙ§ГЬжаИїЮяжЪЕФХЈЖШЫцЪБМфБфЛЏШчЭМЫљЪОЃК
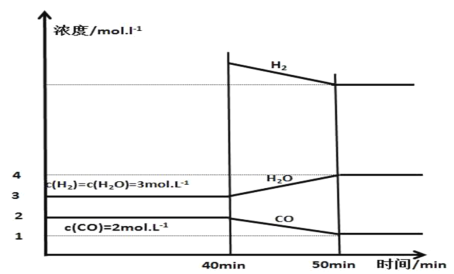
Ђй40minЪБЃЌдйГфШыЕФH2ЕФЮяжЪЕФСПЮЊ________molЁЃ
Ђк40ЁЋ50 minФкH2ЕФЦНОљЗДгІЫйТЪЮЊ________molЁЄLЃ1ЁЄminЃ1ЁЃ
(4)аТаЭЕФФЦСђЕчГивдШлШкН№ЪєФЦЁЂШлШкСђКЭЖрСђЛЏФЦ(Na2Sx)ЗжБ№зїЮЊСНИіЕчМЋЕФЗДгІЮяЃЌЙЬЬхAl2O3ЬеДЩ(ПЩДЋЕМNaЃЋ)ЮЊЕчНтжЪЃЌЦфдРэШчЭМЫљЪОЃК
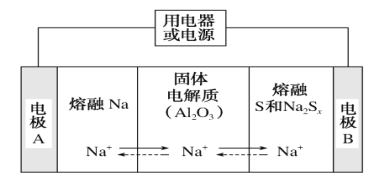
ЂйЗХЕчЪБЃЌЕчМЋAЮЊ________МЋЃЌSЗЂЩњ________ЗДгІЃЈЬюЁАбѕЛЏЁБЛђЁАЛЙдЁБЃЉЁЃ
ЂкГфЕчЪБЃЌзмЗДгІЮЊNa2Sx=2NaЃЋSx(3<x<5)ЃЌNaЫљдкЕчМЋгыжБСїЕчдД________МЋЯрСЌЃЌбєМЋЕФЕчМЋЗДгІЪНЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com