
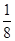 +6×
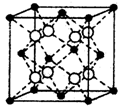
+6×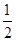 =4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。
=4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题

A.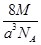 g·cm-3 g·cm-3 | B.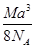 g·cm-3 g·cm-3 |
C.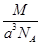 g·cm-3 g·cm-3 | D.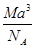 g·cm-3 g·cm-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
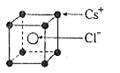
A.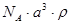 | B. | C.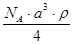 | D.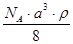 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol C(金刚石)中含有c—c键数目为2NA |
| B.金刚石与石墨互为同素异形体 |
| C.当有0.4molNa参加反应时,消耗的CO2的体积为6.72L |
| D.3molCO2参加反应时.转移电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
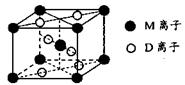
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.熔融时化学键没有破坏的晶体一定是金属晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑦ | B.只有⑦ | C.②④⑤⑦ | D.⑤⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com