
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.分析 (1)铁与水蒸气发生氧化还原反应,生成四氧化三铁和氢气,据此书写化学方程式;
(2)KSCN溶液溶液变红色,说明有三价铁离子;溶液未变红色,说明无三价铁离子;
(3)铁单质能将三价铁离子还原成二价铁离子;
(4)滴入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后变成红褐色;
(5)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质,铁粉能与三价铁离子反应生成二价铁离子.
解答 解:(1)铁与水蒸气发生氧化还原反应,生成四氧化三铁和氢气,方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe 3O4+4H2;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe 3O4+4H2;
(2)KSCN溶液溶液变红色,说明有三价铁离子,说明硬质试管中固体一定有Fe3O4,可能有Fe;KSCN溶液未变红色,说明无三价铁离子,一定有Fe3O4和Fe,
故答案为:一定有Fe3O4,可能有Fe;Fe3O4和Fe;
(3)铁单质能将三价铁离子还原成三价铁离子离子方程式,Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(4)滴入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后变成红褐色,该反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质,铁粉能与三价铁离子反应生成二价铁离子,所以配制含Fe2+的盐溶液时应加入少量 铁粉;
故答案为:还原;Fe2+ 易被空气中的氧气氧化而变质;铁粉.
点评 本题以铁与水的反应考查氧化还原反应,明确物质的性质及反应中元素的化合价变化,掌握铁和水蒸气反应的原理和产物的检验是解答的关键,注意不同价态铁元素之间的转化.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
 NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH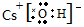 HSCN
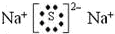
HSCN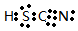 O22-
O22- .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化是,c(I-):c(Br-)═1:1 | |
| D. | 当a=0.28时,4Fe2++10I-+7Br2═4Fe3++5I2+14Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
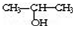 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2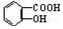 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备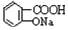
| A. | 只有③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室应将钠保存在煤油中 | |
| B. | 分液漏斗和容量瓶在使用前都要检漏 | |
| C. | 可用酒精代替CCl4萃取碘水中的碘单质 | |
| D. | 金属镁失火不可用水来灭火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com