
分析 (1)酒精与水互溶;
(2)萃取需要铁架台、分液漏斗、烧杯;
(3)四氯化碳的密度比水的密度大,分层后有机层在下层;
(4)分液时,先分离出下层液体,避免上下层液体混合.
解答 解:(1)酒精与水互溶,则酒精不能作萃取剂,故答案为:否;
(2)萃取实验需要铁架台、分液漏斗、烧杯,故答案为:分液漏斗;
(3)四氯化碳是无色、密度比水大的液体.静置分层时下层液体的颜色为紫色,上层液体是H2O,故答案为:无;大;紫;H2O;
(4)分液时,先分离出下层液体,避免上下层液体混合,则分液时,下层液体沿分液漏斗下端导管流下,上层液体从分液漏斗上口倒出,
故答案为:分液漏斗下端导管;上口.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意萃取、分液的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K+、CO32-、SO42- | B. | Fe3+、Na+、NO3-、SO42- | ||
| C. | Mg2+、Ba2+、OH-、NO3- | D. | K+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
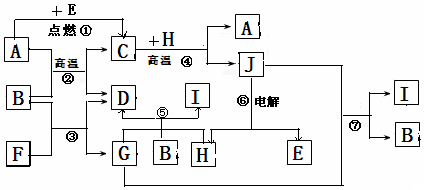
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
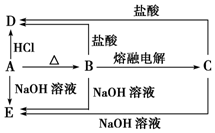 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448 kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6 kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H-O键比H-N键弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com