

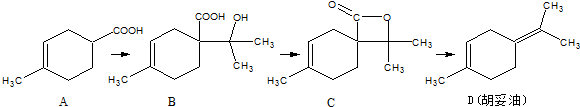
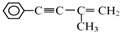 的反应条件是浓硫酸、加热.
的反应条件是浓硫酸、加热.
 或
或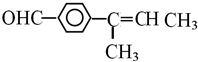 (任写一个)
(任写一个)分析 根据图知,A发生取代反应生成B,B发生酯化反应或取代反应生成C,C消去反应生成D;
(1)由I的结构可知分子式,B中含-COOH、-OH及双键三种官能团;
(2)有机物Ⅲ制备时-OH转化为双键;
(3)由合成A的流程可知,B→C时-COOH、-OH发生酯化反应,C→D由原子守恒可知另一生成物;
(4)结合信息分析A→B的反应是偶联反应,与-COOH相连C上的H与2-溴-2-丙醇发生取代反应;
(5)A.有机物Ⅲ中苯环、三键均与氢气发生加成反应;
B.苯与溴水不反应;
C.有机物B中含双键、-COOH、-OH;
D.有机物A的分子式为C8H12O2,结合燃烧规律分析消耗氧气;
(6)化合物Ⅲ的同分异构体满足:
①含有一个苯环,且苯环上一氯取代物有2种同分异构体,说明苯环上有两种氢原子;
②能发生银镜反应,说明含有醛基;
③能使溴的CCl4溶液褪色,说明含有碳碳双键;
④结构中含2个甲基.
解答 解:根据图知,A发生取代反应生成B,B发生酯化反应或取代反应生成C,C消去反应生成D;
(1)由I的结构可知分子式为C5H8O,B中含-COOH、-OH及双键三种官能团,含氧官能团名称为羧基、羟基,故答案为:C5H8O;羧基、羟基;
(2)有机物Ⅲ制备时-OH转化为双键,则反应条件为浓硫酸、加热,故答案为:浓硫酸、加热;
(3)由合成A的流程可知,B→C时-COOH、-OH发生酯化反应,则反应类型为酯化反应或取代反应,C→D由原子守恒可知另一生成物为CO2,
故答案为:酯化反应或取代反应;CO2;
(4)结合信息分析A→B的反应是偶联反应,与-COOH相连C上的H与2-溴-2-丙醇发生取代反应,该反应为 ,故答案为:
,故答案为: ;
;
(5)A.有机物Ⅲ中苯环、三键均与氢气发生加成反应,则1mol有机物Ⅲ最多可与5mol H2加成,故A正确;
B.苯与溴水不反应,则不能制备,应利用苯、液溴在Fe作催化剂的条件下合成,故B错误;
C.有机物B中含双键可发生氧化、加聚反应,含-COOH可发生取代、酯化反应,含-OH可发生取代、氧化、消去反应,故C正确;
D.有机物A的分子式为C8H12O2,则1mol有机物A完全燃烧可消耗1mol×(8+$\frac{12}{4}$-$\frac{2}{2}$)=10molO2,故D正确;
故答案为:ACD;
(6)化合物Ⅲ的同分异构体满足:
①含有一个苯环,且苯环上一氯取代物有2种同分异构体,说明苯环上有两种氢原子;
②能发生银镜反应,说明含有醛基;
③能使溴的CCl4溶液褪色,说明含有碳碳双键;
④结构中含2个甲基,则符合条件的同分异构体结构简式为 或
或  ,
,
故答案为: 或
或  .
.
点评 本题考查有机物的合成及推断,为高频考点,把握合成流程中的反应、官能团变化、同分异构体推断为解答的关键,侧重分析与推断能力的考查,难点是同分异构体结构简式的确定.


科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 反应类型 |
| A | 四氯化碳和苯酚都能使溴水褪色 | 取代反应 |
| B | 甲苯和甲酸都能使酸性高锰酸钾溶液褪色 | 氧化反应 |
| C | 一氯甲烷和乙醇都能制备乙烯 | 消去反应 |
| D | 聚乙烯和聚乙炔都能使溴的四氯化碳溶液褪色 | 加成反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用浓硫酸干燥SO2气体 | |
| B. | 准确量取25.00 mL的液体可选用量筒或滴定管等量具 | |
| C. | 无色气体燃烧后生成的气体通入Ba(OH)2溶液,有白色沉淀生成,则原气体一定是CO | |
| D. | FeCl3、CuCl2的混合液中加铁粉充分反应后仍有固体存在,再加KSCN溶液可呈现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 利用黄花蒿叶研究青蒿素结构的基本步骤为:元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 | |
| B. | ①、②的反应类型分别为还原反应、酯化反应 | |
| C. | 双氢青蒿素在水中的溶解性大于青蒿素 | |
| D. | 双氢青蒿素与蒿甲醚组成上相差-CH2-,二者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )| A. | 该电池可实现把化学能全部转化为电能 | |
| B. | 电极b上发生的电极反应为:02+2H2O+4e-=40H- | |
| C. | 电极a上发生的电极反应为:2H2S-4e-=S2+4H+ | |
| D. | 标况下,当有22.4LH2S参与反应时,有2mo1H+经质子膜进入负极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1, I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、NH4+、SO42-、CO32- | |
| B. | 与铝反应产生大量氢气的溶液中:Ca2+、Fe2+、Cl-、NO3- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-6的溶液中:K+、Na+、I-,SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液中:Na+、K+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 | |
| B. | 应该选择酚酞作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com