
| A. | 醛基的结构简式-COH | |
| B. | 2-乙基-1,3-丁二烯分子的键线式: | |
| C. | 比例模型 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 四氯化碳分子的电子式: |
分析 A.醛基中存在碳氧双键,结构简式书写错误;
B..2-乙基-1,3-丁二烯含2个双键,2号C上有乙基,用线表示化学键,用折点表示C原子,以此表示键线式;
C.比例模型既能表示分子的空间结构,又能表示出分子中各原子的相对大小,与分子的真实结构最接近;
D.氯原子未成键的孤对电子对未标出.
解答 解:A.醛基为醛类的官能团,醛基的结构简式为:-CHO,故A错误;
B.2-乙基-1,3-丁二烯含2个双键,2号C上有乙基,键线式为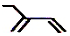 ,故B正确;
,故B正确;
C.比例模型 可以表示甲烷分子,但Cl原子半径大于C原子半径,不能表示四氯化碳分子,故C错误;
可以表示甲烷分子,但Cl原子半径大于C原子半径,不能表示四氯化碳分子,故C错误;
D.氯原子未成键的孤对电子对未标出,四氯化碳电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查常见化学用语的判断,为高频考点,题目难度不大,注意掌握结构简式、键线式、比例模型、电子式等化学用语的概念及表示方法,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:多选题
| A. | 只含H、N、O三种元素的化合物,可能是离子化含物,也可能是共价化合物 | |
| B. | 元素周期表中,ⅠA族与ⅦA族元素间只能形成离子化合物 | |
| C. | NaHCO3、CH3COONa均含有离子键和共价键 | |
| D. | 化合物MgO、SiO2、SO3中化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .A中反应的氧化剂和还原剂的物质的量之比为1:2.
.A中反应的氧化剂和还原剂的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.有关说法错误的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.有关说法错误的是( )| A. | 中间室Cl-移向左室 | |
| B. | 反应后将左右两室溶液混合比反应前将两室溶液混合的酸性强 | |
| C. | 气体X为CO2 | |
| D. | 左边离子交换膜为氯离子交换膜,右边离子交换膜为钠离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
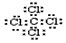 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和硝酸银用棕色试剂瓶保存 | |
| B. | 常温下铁和铂都不溶于浓硝酸 | |
| C. | 亚硫酸盐和硫酸亚铁固体长期暴露在空气中变质 | |
| D. | H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═2H2O+3S↓ | |
| D. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com