
原子轨道的杂化不但出现在分子中,原子团中同样存在杂化轨道的。在 SO42-中S原子的杂化方式为( )
A.sp B.sp2 C.s p3 D.无判法断
科目:高中化学 来源:2016届内蒙古赤峰二中高三第四次模拟理综化学试卷(解析版) 题型:填空题
冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)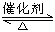 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①一定条件下,在一个容积固定为2L的密闭容器中充入0.8mol NO和1.2mol CO,开始反应至2min时测得CO转化率为20%,则用N2表示的平均反应速率为v(N2)=_________。
②对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应平衡常数的表达式KP=_________。
③该反应在低温下能自发进行,该反应的△H_________0(填“>”、“<”)
④在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是_________(填编号)
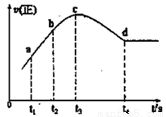
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2>t2~t3
(2)使用甲醇汽油可以减少汽车尾气对环境的污染.某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应CO(g)+2H2(g)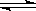 CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)_________v(逆)(填“>”、“<”或“=”),判断的理由_________。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)_________v(逆)(填“>”、“<”或“=”),判断的理由_________。
(3)二甲醚也是清洁能源.用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)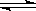 CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比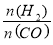 的变化曲线如图:
的变化曲线如图:
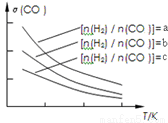
①a、b、c按从大到小的顺序排序为_________。
②某温度下,将某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3所示,关于温度和压强的关系判断正确的是_________
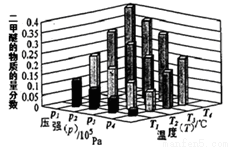
A.P3>P2,T3>T2B.P1>P3,T1>T3
C.P2>P4,T4>T2D.P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_________
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是 ( )
序号 | ① | ② | ③ | ④ | ⑤ |
甲 | CO2 | HCl | CO2 | NO2 | CO2 |
乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
A.②③④ B.①②③④ C.①③④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为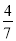 计算:
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。(不带单位)
N2(g)+3H2(g)的平衡常数。(不带单位)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
利用LiOH可制备锂离子电池正极材料。LiOH可由电解法制备,如右图,两极区电解质溶液分别为LiOH和LiCl溶液。下列说法错误的是
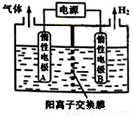
A.B极区电解质溶液为LiOH溶液
B.阳极电极反应式为2Cl--2e-=Cl2↑
C.电解过程中主要是H+通过阳离子交换膜向B电极迁移
D.电极A连接电源的正极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:推断题
某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且能够防止环境污染,现按以下方式进行处理利用:

试回答:
(1)A的名称是____________;
(2)写出D的同分异构体的结构简式____________。
(3)D到E的反应类型为____________,D到E的反应试剂可以为____________。
(4)实验室制备H后,提纯H的分离方法为____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:填空题
某同学所做的有关铜元素的实验流程如图:

(1)写出基态铜原子的价电子排布式________________________,向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键的类型有________________________。
(2)写出反应④的离子方程式________________________。
(3)铜能与类卤素(SCN) 2反应生成Cu(SCN) 2,1 mol (SCN)2分子中含有的δ键数目为类卤素(SCN)2 对应的酸有两种,理论推测硫氰酸(H-S-C N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
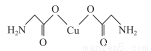
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为____________________。
(5)铜晶胞中,其晶体的堆积方式为_______________,一个晶胞中铜原子的数目为__________,空间利用率为____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用不相对应的是
A. 氨气能与氯气生成氯化铵,可用浓氨水检验输送氯气的管道是否泄漏
B.SO2有强还原性,用 SO2漂白纸浆
C.熟石膏与水的糊状混合物会很快凝固,可用它制作模型和石膏绷带
D.铝有强还原性且转化为氧化铝时放出大量的热,可用铝粉来还原某些金属氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com