
【题目】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA﹣ , Ⅲ代表A2﹣).根据图示判断,下列说法正确的是( ) 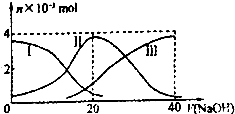
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系 c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)
B.等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加人水的过程中,pH可能增大也可能减小
【答案】A
【解析】解:A.当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液中溶质为NaHA,由于c(A2﹣)>c(H2A),所以HA﹣电离程度大于水解,溶液显酸性,则溶液中离子浓度大小为:c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣),故A正确;
B.等体积等浓度的NaOH溶液与H2A溶液混合后,由图示关系知,c(A2﹣)>c(H2A),说明电离大于水解程度,c(H+)>c(OH﹣),溶液显酸性,溶液中氢离子抑制了水的电离,溶液中水的电离程度比纯水小,故B错误;
C.由图示关系知,NaHA溶液中c(A2﹣)>c(H2A),溶液显示酸性,如果使溶液呈中性,应该向溶液中加入碱溶液,不能加入酸溶液,故C错误;
D.NaHA溶液加人水的过程中,HA﹣电离程度增大,但是溶液中氢离子浓度减小,溶液的pH增大,故D错误;
故选A.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列有关卤族元素的说法中,正确的是( )
A.酸性:HFO4>HClO4
B.最外层电子数:Br>I
C.密度:Cl2>Br2
D.热稳定性:HBr>HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在CH3COOHCH3COO﹣+H+ . 要使溶液中 ![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱固体
B.升高温度
C.加少量冰醋酸
D.加少量醋酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-A kJ·mol-1
②2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+ B kJ·mol-1
③2H2O(g)=2H2O(l) ΔH=-C kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式__________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
物质 浓度(mol/L)时间(min) | NO | N2 | CO2 |
0 | 0.0100 | 0 | 0 |
10 | 0.0058 | 0.0021 | 0.0021 |
20 | 0.0040 | 0.0030 | 0.0030 |
30 | 0.0040 | 0.030 | 0.0030 |
40 | 0.0032 | 0.0034 | 0.0017 |
50 | 0.0032 | 0.0034 | 0.0017 |
①下列说法能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量
B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变
D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②压强平衡常数Kp,仅适用于气相平衡,以分压表示各成分的浓度,分压PA=P总 X nA%在T0C时,平衡总压为P,该反应的压强平衡常数的计算式为______________;
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是氢氧燃料电池的示意图,按图中提示,下列叙述不正确的是( )

A. a电极是负极,b电极是正极
B. a电极的电极反应式为H2-2e-===2H+
C. b电极的电极反应式为4OH--4e-===2H2O+O2↑
D. 氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序数都小于18。A微粒的最外层电子数比次外层多5个;金属原子B的原子核内质子数比前一周期的同族元素多8个,其单质不能从CuSO4溶液中置换出Cu;C元素有3种同位素:C1、C2、C3,C1的质量数分别为C2、C3的![]() 和
和![]() ;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
(1)写出五种微粒的表示符号:A________、B________、C________、D________、E________。
(2)写出C的同位素名称:C1________、C2________、C3________。
(3)C和D形成的10个电子的分子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(g),达到反应限度的标志是
Y(g)+Z(g),达到反应限度的标志是
①X的分解速率与X的生成速率相等 ②反应容器中压强不再变化
③X、Y、Z的浓度不再变化 ④单位时间内生成1molY的同时生成1molZ
A.①③ B.②③ C.①② D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同周期元素中,ⅠA族元素的原子半径最小
B.仅由非金属元素不可能形成离子化合物
C.目前使用的元素周期表中,最长的周期含有32种元素
D.凡是有化学键断裂的过程一定发生了化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com