



| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ③>①>②>④ | D. | ①>②>④>③ |
分析 X为S原子,Y为Cl原子,Z2-为S2-,W为F原子,电子层数越多,半径越大,同周期随原子序数增大,原子半径减小,同种元素的阴离子的半径大于原子半径;
解答 解:①基态X的原子结构示意图: ,则X为S原子,
,则X为S原子,
②基态Y的价电子排布式:3s23p5,则Y为Cl原子,
③基态Z2-的电子排布图: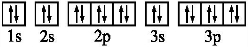 ,Z2-为S2-,
,Z2-为S2-,
④W基态原子有2个能层,结合电子式可知,W为F原子;
电子层数越多,半径越大,F<Cl,同周期随原子序数增大,原子半径减小,则半径:S>Cl,同种元素的阴离子的半径大于原子半径,则半径:S<S2-;
所以半径:S2->S>Cl>F,③①②④
故选C.
点评 本题考查原子半径大小比较,侧重考查分析能力,明确原子半径比较方法是解本题关键,离子半径大小比较也是常考查点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 还原性:Na+>S2->Br->Cl- | ||
| C. | 热稳定性:PH3>H2S>HCl>HF | D. | 水溶液酸性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C物质的分子数之比为1:3:2 | |
| B. | 容器内气体的密度不再随时间而改变 | |
| C. | 容器内气体的压强不再随时间而改变 | |
| D. | 单位时间内生成a mol物质A,同时生成3a mol物质B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH:②>③>④>① | B. | 溶液中c(H+):①>③>②>④ | ||
| C. | c(CH3COO-):②>④>③>① | D. | c(CH3COOH):①>④>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其晶体中的化学键类型为离子键、共价键
,其晶体中的化学键类型为离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内NO2的生成速率为2.96×10-3mol•L-1•s-1 | |
| B. | T1温度下该反应平衡时N2O5的转化率为29.6% | |
| C. | 达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00mol/L | |
| D. | 若温度由T1升至T2时,正逆反应速率都增大,且化学平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂 V2O5 不改变该反应的逆反应速率 | |
| B. | 恒压,通入稀有气体,反应速率不变 | |
| C. | 该反应是放热反应,降低温度反应速率变大 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO2 (g)消耗的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com