
【题目】(化学——选修2:化学与技术)
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:
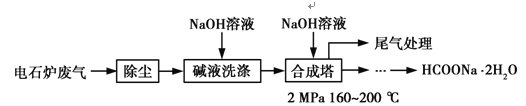
(1)上述工艺用碱液洗涤的目的是___________,可能发生的反应有______________(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________;最后尾气主要成分是__________________。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________。
【答案】除去其中的CO2、H2S等酸性气体 CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O 使尾气中的CO被充分吸收 N2和CH4 2HCOONa![]() Na2C2O4+H2↑ HCOO-+2SO2+OH-=S2O42-+CO2+H2O 4.12×104L
Na2C2O4+H2↑ HCOO-+2SO2+OH-=S2O42-+CO2+H2O 4.12×104L
【解析】
电石炉废气先除尘,然后用碱液洗涤,溶液中的二氧化碳和硫化氢反应生成盐,然后将气体通入合成塔,并加入氢氧化钠溶液,加热至160-200度,加压,最终得到甲酸钠晶体,最后剩余氮气和甲烷,将尾气排空。
试题(1)碱液具有碱性,能吸收酸性气体,二氧化硫和硫化氢都是酸性气气体,被碱液吸收,所以作用为除去其中的CO2、H2S等酸性气体,反应方程式为:CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O。
(2)反应物接触面积越大,反应越充分,合成工艺中采用循环喷射吸收合成目的是增大反应物接触面积,使尾气中的CO被充分吸收,反应过程中N2和CH4不参加反应,所以最后排空的尾气主要成分是氮气和甲烷。
(3)甲酸钠高温分解生成草酸钠和氢气,方程式为2HCOONa![]() Na2C2O4+H2↑。
Na2C2O4+H2↑。
(4)反应物是甲酸钠,氢氧化钠和二氧化硫,生成物是Na2S2O4和二氧化碳和水,离子方程式为:HCOO-+2SO2+OH-=S2O42-+CO2+H2O。
(5)5%的甲酸钠溶液1吨,含有甲酸钠的物质的量为1000000×5%/68=735.3摩尔,根据碳元素守恒,甲酸钠生成产率为40%,则需要一氧化碳的物质的量为735.3/40%=1838.3摩尔,一氧化碳的体积为1838.3×22.4=4.12×104L。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
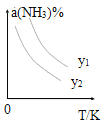
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的/span>NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料甲和G都在生活中有很多用途,其合成路线如下:
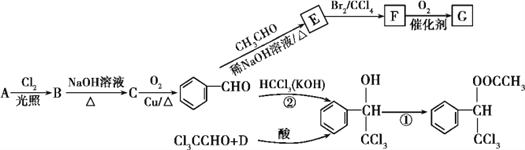
已知:①R1—CHO+R2—CH2—CHO![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是____,G中含氧官能团的名称是____。
(2)②的反应类型是____,B和F的结构简式分别为______、______。
(3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。
(4)写出反应①的化学方程式:_____________。
(5)G的同分异构体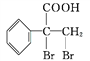 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_________。
为原料设计它的合成路线(其他所需原料自选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知各种硝基苯酚的性质如下表:
名称 | 结构式 | 溶解度/(g/100 g水,25 ℃) | 熔点 /℃ | 沸点 /℃ |
邻硝基苯酚 |
| 0.2 | 45 | 100 |
间硝基苯酚 |
| 1.4 | 96 | 194 |
对硝基苯酚 |
| 1.7 | 114 | 295 |
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔沸点低于另两种硝基苯酚
B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2]是一种重要的工业原料,在160℃分解生成异氰酸和氨气,化学方程式为CO(NH2)2![]() 2HCNO+NH3↑。回答下列问题:
2HCNO+NH3↑。回答下列问题:
(1)上述反应所涉及的各元素中,原子半径最大的是________(填元素符号),其原子核外电子共占据________个原子轨道。
(2)上述元素中有三种元素处于同周期,则:
①最简单气态氢化物的稳定性由大到小的顺序是________(用化学式表示)。
②元素的第一电离能由大到小的顺序是________(用元素符号表示,下同)。
③元素的电负性由大到小的顺序是________________。
(3)氰酸有两种结构,一种分子内含有三键,称为氰酸,另一种分子内不含三键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。写出氰酸和异氰酸的结构式:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是_______L
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是_______________mol,燃烧产物的平均摩尔质量是____________g/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁不溶于水,用途广泛,主要用作橡胶制品的填充剂,能增强橡胶的耐磨性和强度。也可用作油漆和涂料的添加剂,也可用于牙膏、医药和化妆品等工业。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
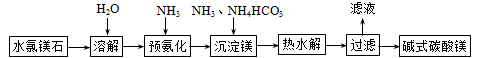
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Ksp(Mg(OH)2)=1.8×10-11,表示Mg(OH)2沉淀溶解平衡的方程式为 ,Mg(OH)2达到沉淀达到沉淀溶解平衡时溶液的pH (已知:lg36≈1.5)。
(2)已知:常温下Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11,Kb(NH3·H2O)=1.8×10-5,则NH4HCO3溶液显 性,c(NH) c(HCO)(选填“大于”、“小于”、“等于”),该溶液物料守恒表达式为 。
(3)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____________。
(4)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁晶体4.84 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,则碱式碳酸镁的化学式为 ,写出氯化镁、氨、碳酸氢铵热水解生成碱式碳酸镁的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2.现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度分别为h1、h2、h3、h4,则高度关系是
A.h4>h2>h3>h1 B.h4>h3>h2>h1
C.h2>h3>h1>h4 D.h3>h2>h1>h4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s)B.υ(D)= 1 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s)D.υ(B)= 0.3 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com